(C) Communication LIH
LIH-Wissenschaftler entdecken unbekannten Immun-Mechanismus
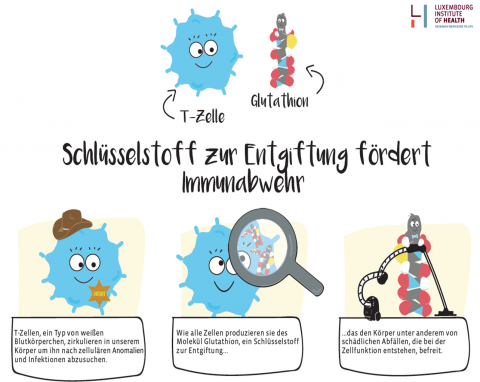

Wissenschaftler des Luxembourg Institute of Health (LIH) haben einen bisher unbekannten molekularen Mechanismus entdeckt, der die Aktivierung des menschlichen Immunsystems fördert. Das Team um LIH-Forscher Prof. Dirk Brenner, Leiter der Arbeitsgruppe „Experimental & Molecular Immunology“ im „Department of Infection and Immunity„ des LIH und FNR ATTRACT Fellow, hat rund um den Stoff Glutathion geforscht, ein Molekül das unter anderem von weißen Blutkörperchen namens T-Zellen hergestellt wird, und für seine Rolle in der Reinigung des Körpers von schädlichen Stoffwechselabfällen bekannt ist. Ihre Forschungsarbeit hat erwiesen, dass Glutathion auch den Energiestoffwechsel der T-Zellen ankurbelt. Um es einfach auszudrücken: Glutathion ist wichtig damit T Zellen genug Energie bekommen und dadurch beim Kontakt mit Krankheitserregern wachsen, sich teilen und Eindringlinge wie Viren bekämpfen. Es ist also essentiell für eine optimale Immunantwort. Diese Erkenntnis bietet Ansatzpunkte, um Krebs oder Autoimmunerkrankungen unter einem neuen Blickwinkel zu erforschen und verbesserte Therapieansätze zu entwickeln.
Ihre Ergebnisse veröffentlichen die Forscher heute im Journal „Immunity“, der weltweit angesehensten Fachzeitschrift im Bereich Immunologie (DOI: 10.1016/j.immuni.2017.03.019.).
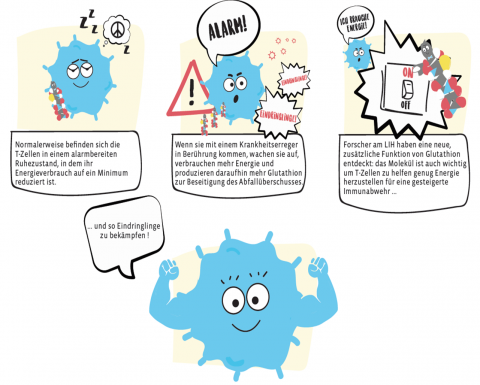
„Unser Körper muss das Immunsystem in einer sorgfältig austarierten Balance halten“, sagt Prof Dirk Brenner. „Wenn die körpereigene Abwehr zu aktiv ist, richtet sie sich gegen den Körper. Das ist beispielsweise bei Autoimmunerkrankungen wie Multipler Sklerose oder Arthritis der Fall. Ist sie zu schwach, können unkontrollierte Infektionen oder Körperzellen, die sich ungebremst vermehren und Tumore bilden, zur lebensbedrohlichen Gefahr werden.“ Immunzellen wie die T-Zellen halten deshalb im Normalfall eine Art alarmbereiten Winterschlaf, bei dem ihr Energieverbrauch auf ein Minimum reduziert ist. Wenn Krankheitserreger oder Teile davon an ihre Außenhülle andocken, wachen die T-Zellen auf und intensivieren ihren Stoffwechsel. Dadurch entstehen verstärkt stoffwechselbedingte Abfallprodukte, beispielsweise reaktive Oxidantien und freie Radikale, welche toxisch auf die Zellen wirken können.
Steigt die Konzentration der Oxidantien, müssen die T-Zellen Antioxidantien herstellen, um nicht von innen vergiftet zu werden. Die Wirkungsmechanismen von Antioxidantien in T-Zellen hatte bisher noch keine wissenschaftliche Arbeitsgruppe im Detail untersucht. Prof. Brenners Team widmete sich dem Thema und fand heraus: Das von T-Zellen hergestellte Antioxidans Glutathion dient nicht nur als Entgiftung zur Beseitigung reaktiver Oxidantien und freier Radikale – es ist auch ein zentraler Schalter des Energiestoffwechsels, der die Immunantwort regelt, und ist somit auch von Relevanz für verschiedenste Erkrankungen. „Diese faszinierenden Ergebnisse bilden eine Basis, um gezielt in den Stoffwechsel von Immunozellen einzugreifen und eine neue Generation von Immun-Therapeutika zu entwickeln “, erklärt Prof. Markus Ollert, Direktor des „Department of Infection and Immunity“ am LIH.
Für ihre Untersuchungen setzten die Forscher Kleintiermodelle ein, die kein Glutathion produzieren können. „Bei diesen Mäusen haben wir festgestellt, dass sie Viren nicht in Schach halten können – die Mäuse haben eine Immunschwäche, die aber andererseits dazu führt, dass sie auch keine Autoimmun-Erkrankung wie Multiple Sklerose entwickeln.“ Den Grund dafür zeigen weitere Versuche, die Prof. Brenners Team gemacht hat: „Die Mäuse können in ihren T-Zellen kein Glutathion herstellen“, so Prof. Brenner, „und dadurch werden in den T-Zellen einige weitere Signalstoffe nicht gebildet, die unmittelbar den Stoffwechsel intensivieren und den Energieverbrauch ansteigen lassen.“ Die Folge: Ohne Glutathion sind die T-Zellen nicht voll funktionsfähig; sie verharren in ihrem Ruhezustand, und eine selbstzerstörende Autoimmunreaktion unterbleibt. Prof. Karsten Hiller von der Technischen Universität in Braunschweig, der mit den luxemburgischen Wissenschaftlern eng zusammen arbeitet ergänzt: „Es ist faszinierend zu sehen, dass der Zellstoffwechsel und die Immunaktivierung so eng verstrickt sind, und eine korrekte Funktion nur durch ein balanciertes Zusammenspiel zu erreichen ist.“
Seine Untersuchungen an den T-Zellen sieht Prof. Brenner als Auftakt zur genaueren Erforschung des Energiehaushalts von Immunzellen generell. So hängen verschiedene Autoimmunkrankheiten mit Fehlfunktionen unterschiedlicher Untergruppen von T-Zellen zusammen: „Wenn wir verstehen, wie sich die molekularen Mechanismen unterscheiden, mit denen T-Zellen ihren Stoffwechsel im Falle einer Abwehr- oder Autoimmunreaktion anregen, können wir Hinweise auf mögliche Angriffsstellen therapeutischer Wirkstoffe gewinnen.“ Ähnlich sieht der Forscher die Situation bei Krebs: „Auch hier ist es wichtig zu wissen, wieso die Immunzellen, die eigentlich Krebszellen bekämpfen müssten, auf ein niedriges Stoffwechselniveau absinken und teilweise eine Immunreaktion gegen den Tumor sogar aktiv unterdrücken. Gegensteuernde stoffwechselanregende Maßnahmen könnten zu effizienteren Arbeit der Immunzellen und zu einer besseren Bekämpfung des Krebses führen.“
Autor : LIH
Foto : (C) Communication LIH
Infobox
Prof. Dirk Brenner ist der „Deputy Head of Research & Strategy“ an LIHs „Department of Infection and Immunity“. Er erhielt 2015 eine prestigeträchtige ATTRACT Consolidator Förderung des Luxemburger „Fonds National de la Recherche“ (FNR), um die Arbeitsgruppe „Experimental & Molecular Immunology" aufzubauen. Das FNR-ATTRACT-Programm unterstützt die luxemburgischen Forschungseinrichtungen um herausragende junge Wissenschaftler nach Luxembourg zu rekrutieren.
Die Studie wurde in enger Zusammenarbeit mit dem ehemaligen FNR ATTRACT Fellow Prof. Karsten Hiller der Arbeitsgruppe „Metabolomics“ des „Luxembourg Centre for Systems Biomedicine“ an der Universität Luxemburg (jetzt Professor am Integrated Centre of Systems Biology (BRICS) der Technischen Universität Braunschweig, Deutschland) und mit Prof. Tak W. Mak dem Direktor des „Campbell Family Institutes for Breast Cancer Research“ an der Universität von Toronto, Kanada, durchgeführt.
Das Luxembourg Institute of Health ist ein öffentliches Forschungsinstitut an der Spitze der biomedizinischen Forschung. Mit seinen Knowhow in den Schwerpunkten öffentliche Gesundheit, Krebserkrankungen, Infektion und Immunität sowie in der Lagerung und Bearbeitung von biologischen Proben, engagiert sich das Institut durch seiner Forschungsarbeiten für die Gesundheit der Menschen. Am Luxembourg Institute of Health arbeiten mehr als 300 Personen mit dem gemeinsamen Ziel das Wissen über Krankheitsmechanismen voranzutreiben und so neue Diagnoseverfahren, innovative Therapieansätze und effiziente Tools für die personalisierte Medizin zu entwickeln. Das Institut ist der erste Anbieter von Informationen zur öffentlichen Gesundheit in Luxemburg, ein verlässlicher Kooperationspartner für lokale und internationale Projekte sowie ein attraktiver Ausbildungsplatz für Nachwuchsforscher.