Wikimedia Commons
Le premier accumulateur au lithium a été développé en laboratoire, en 1980, par John Goodenough et Koichi Mizushima (Oxford University, England). Ils mirent au point un accumulateur au lithium de 4 V avec une électrode positive au LiCoO2 et une électrode négative au lithium métallique.
En 1991, un accumulateur lithium-ion a été commercialisé pour la première fois par Sony. Depuis elle a connu un développement fulgurant de sorte qu’elle occupe aujourd'hui une place prédominante sur les marchés de l'électronique portable ainsi que de l’électromobilité (voiture et bus électriques, tram).
C’est grâce à des accumulateurs lithium-ion que le tram de Luxembourg peur circuler sans ligne aérienne de contact.
Les principaux avantages de l’accumulateur lithium-ion sont une énergie massique (énergie stockée par kg) élevée ainsi que l'absence d'effet mémoire. Enfin, l'auto-décharge est relativement faible par rapport à d'autres accumulateurs.


Photo (gauche) : Exemple d’un accumulateur Nokia Li-ion, alimentant de nombreux portables
Photo (droite) : Figure 1 Bloc d’accumulateurs lithium-ion de la voiture électrique Nissan LEAF
Comment fonctionne l’accumulateur lithium-ion ?
Tout accumulateur chargé, de même que toute pile, possède deux pôles électriques différents : un pôle positif (défaut d’électrons) et un pôle négatif (excès d’électrons). Il existe donc une tension électrique entre leurs pôles et ils contiennent de l’énergie. Cette énergie se trouve emmagasinée dans les matériaux qui les constituent. On l’appelle énergie chimique car elle est due à des liaisons chimiques entre les atomes qui constituent ces matériaux.
Le principe de fonctionnement d’une pile ou d’accumulateur est le suivant : Lorsqu’on relie les deux pôles par un conducteur un courant électrique (continu) prend naissance dans ce conducteur. L’énergie chimique des matériaux est alors transformée en énergie électrique véhiculée par les électrons qui forment le courant. Les électrons cèdent leur énergie au conducteur qui s’échauffe : l’énergie électrique est transformée en énergie calorifique.
La transformation d’énergie chimique en énergie électrique est due à des réactions chimiques à l’intérieur de l’accumulateur. De nouveaux matériaux appauvris en énergie chimique se forment. Alors qu’une pile épuisée devient inutilisable un accumulateur peut être rechargé à l’aide d’un chargeur adapté. Les réactions chimiques à l’intérieur de l’accumulateur se déroulent alors exactement dans le sens inverse de sorte que l’accumulateur revient à son état initial.
Quelle est la cause de l’apparition d’un pôle + et d’un pôle - ?
En principe, deux différents matériaux en contact avec un électrolyte (= liquide conducteur électrique par l’intermédiaire d’ions exclusivement) ont des tendances différemment fortes à faire entrer des ions positifs en solution.
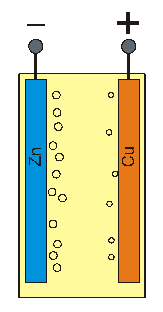
Figure schématique : La tendance à entrer en solution dans l’électrolyte (en jaune) sous forme d’ions positifs (petits cercles) est plus prononcée pour le zinc que pour le cuivre.
Par exemple, les ions Zn2+ ont une tendance plus prononcée à entrer en solution que les ions Cu2+ du cuivre. L’électrode de Zn cède donc davantage d’ions positifs à l’électrolyte que l’électrode de cuivre. Celui qui cède le plus d’ions positifs est le plus négatif. La borne connectée à l’électrode de Zn constitue donc le pôle négatif et la borne connectée à l’électrode de Cu le pôle positif.
La famille des accumulateurs lithium-ion comptent parmi les accumulateurs les plus performants. D’une part le lithium est le métal le plus léger, et d’autre part, le lithium a la plus forte tendance à céder des électrons, donc à former des ions Li+. Le meilleur a ce jour est peut-être l’accumulateur-lithium-dioxyde de cobalt (LiCoO2) utilisé pour les voitures électriques et aussi, pour faire circuler le tram de Luxembourg sans ligne aérienne.
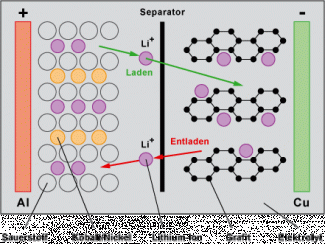
L’électrode positive est formée justement de LiCoO2, d’où le nom donné à ce type d’accumulateur. L’électrode négative est constituée de carbone graphite, une forme de carbone à structure feuilletée. L’électrolyte est un sel de lithium dissout dans un mélange de solvants organiques permettant aux ions Li+ de passer librement d’une électrode à l’autre.
Pour empêcher un court-circuit (si les deux électrodes se touchaient), on place une membrane microporeuse entre les deux électrodes, appelée le séparateur. Ce séparateur est perméable aux minuscules ions Li+.
Lorsque l’accumulateur est chargé il règne une tension de 3,7 V environ entre les deux pôles.
Si on branche un récepteur (moteur, source lumineuse,…) entre ces pôles un courant électrique constitué d’électrons circule. Chaque électron transporte de l’énergie électrique qu’il cède au récepteur. A l’intérieur de l’accumulateur, les ions Li+ passent de l'électrode -, via le séparateur, jusqu’à l’électrode +.
Lorsque l’accumulateur est rechargé, le chargeur impose un courant dans le sens inverse. Les ions Li+ repassent de l’électrode + jusqu’à la structure de graphite feuilletée de l’électrode –, où ils sont stockés.
Auteur : André Mousset
Figures schématiques : André Mousset
Photos : (1) By Kristoferb, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=12279456, (2) By Tennen-Gas - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=8249799, (3) https://www.elektronik-kompendium.de/sites/bau/0810281.htm
Infobox
La charge électrique est « une propriété » (on n’en connaît pas encore la nature intime !) de certaines particules qui interagissent entre elles. Jusqu’à ce jour on a détecté deux sortes de charges : l’une est appelée « charge positive », l’autre « charge négative ». Les particules à même type de charge se repoussent tandis que les particules à types de charge différents s’attirent.
Les électrons ont tous une même charge négative. Ils se repoussent entre eux. Les protons sont tous une même charge positive et se repoussent également mutuellement. Par contre les électrons et les protons s’attirent. Les neutrons ne possèdent pas de charges donc n’interagissent pas de cette façon avec les électrons ou les protons.
La charge d’une particule est mesurable. Il se trouve que l’électron et le proton ont la même charge au signe près. C’est d’ailleurs la plus petite charge qu’on a pu détecter jusqu’à ce jour dans l’univers. Pour cette raison on l’appelle « charge élémentaire ». Elle est notée « e » : e = 1,6 10-19 C.
1 C = 1 coulomb : c’est l’unité de mesure avec laquelle on exprime la charge.
La tension électrique par rapport à la terre est l’énergie électrique que possède une charge de 1 C par rapport à la terre. Elle est mesurable et exprimée en volt.
En effet, une même particule chargée peut avoir beaucoup ou peu d’énergie, ou bien même n’avoir pas d’énergie du tout.
La tension électrique est encore appelée « différence de potentiel électrique ». On peut dire : la ligne aérienne de contact a un potentiel de 750 V et les rails reliés à la terre ont le potentiel 0 V. La tension entre la ligne et les rails (= la différence de potentiel entre la ligne et les rails) vaut alors 750 V.
La terre est par définition toujours au potentiel 0 V.
Un déplacement collectif de particules chargées est appelé « courant électrique ». Or ce sont justement les particules chargées qui possèdent l’énergie électrique. Un courant électrique correspond donc à un transport d’énergie électrique d’un endroit à un autre.
Dans les métaux, les particules chargées susceptibles de créer un courant électrique sont les électrons. En effet chaque atome dispose de un, deux, …, électrons libres, c’est-à-dire, non liés à l’atome. Ces électrons peuvent donc se déplacer à travers l’ensemble du corps métallique et former éventuellement un courant électrique. Pour cette raison les métaux font partie des substances qui conduisent le courant électrique : les « conducteurs électriques ». La vitesse de déplacement des électrons est environ 1 mm/s.
D’autres substances solides ne permettent pas la mise en mouvement collectif des électrons car tous les électrons sont liés aux atomes ou aux molécules. Ces matériaux sont appelés « isolants électriques ».
Dans les liquides, les particules chargées mobiles sont des ions, c’est-à-dire, des atomes, des molécules ou des fragments de molécules ayant un, deux, …, électrons en excès (ions négatifs) ou en défaut (ions positifs). La vitesse de déplacement des ions y est environ 0,01 mm/s.
Dans les gaz, les particules chargées sont à la fois des ions et des électrons. La vitesse de déplacement varie beaucoup et peut être très grande.
Le courant électrique n’est détectable que pas ses effets : échauffement, réactions chimiques dans les liquides, apparition d’un champ magnétique, émission de rayonnements lumineux.
Le courant électrique circule dans un circuit électrique fermé, c’est-à-dire, en partant d’un point, à travers un ensemble de conducteurs électriques, et revenant au point de départ. Pour qu’un courant prenne naissance il faut que deux points du circuit aient des potentiels électriques différents. C’est-à-dire qu’il existe une tension électrique entre deux points du circuit. Le rôle de créer cette tension revient au générateur électrique placé dans le circuit : pile, accumulateur, génératrice, cellule photovoltaïque, …
L’intensité de courant électrique est la quantité de charge qui traverse une section du conducteur par seconde. Elle correspond au débit de l’eau s’écoulant dans une rivière.
Elle est mesurable et exprimée en ampère. Un fil est traversé par un courant de d’intensité 1 A si une charge de 1 C traverse la section du fil en 1 seconde.
Plus l’intensité est élevée, plus l’énergie transportée par le courant est élevée, et plus les effets du courants sont donc importants : échauffement plus important, davantage de réactions chimiques par unité de temps, champ magnétique plus fort, effet lumineux plus important.
Les générateurs de tension continue ont un pôle positif fixe et un pôle négatif fixe. Exemple : pile ou accumulateur. Par définition le courant électrique sort du pôle positif et circule vers le pôle négatif par lequel il entre. Or, si le courant est dû à des électrons (de charge négative), les électrons sortent du générateur par le pôle négatif et rentrent par le pôle positif. Un tel courant est continu car il circule toujours dans le même sens.
Les générateurs de tension alternative changent constamment de polarité. Cela veut dire que le courant circule tantôt dans un sens, tantôt dans l’autre sens. Le courant est alternatif.
Un champ magnétique est une région de l’espace dans laquelle des actions magnétiques peuvent être mises en évidence. Ces actions magnétiques sont des forces s’exerçant sur des aimants, des courants électriques ou bien des particules électriquement chargées en mouvement. (En fait, des particules chargées en mouvement sont équivalents à un courant électrique.)
Or, de telles forces sont exercées par les aimants et les courants placés à proximité. Les régions de l’espace entourant les aimants et les courants électriques sont donc des champs magnétiques.
Autour de notre planète Terre règne également un champ magnétique. Il est dû au mouvement des matières fluides à l’intérieur de la Terre, contenant des particules chargées.
Un champ magnétique peut être plus ou moins intense selon l’effet qu’il produit. Son intensité est exprimée en teslas (T). Le champ créé par un aimant ordinaire se situe à environ 10-3 T. Le champ terrestre vaut en moyenne 5∙10-5 T à proximité de la Terre. Un champ de même intensité règne à 4 mm d’un fil parcouru par un courant de 1 A. Pour obtenir un champ plus fort, il faut disposer un grand nombre de fils parcourus chacun par un fort courant.
Les électroaimants créent ainsi un champ magnétique plus ou moins puissant grâce à des bobines à un grand nombre de spires. Ces bobines comportent en plus un noyau de fer (fermé) qu’s’aimante dans le champ de la bobine renforçant celui-ci.
- http://www.elektromodellflug.de/files/Lit-Akku-Techn-Einfuehrung.pdf
- https://electronics.howstuffworks.com/everyday-tech/lithium-ion-battery1.htm
- https://sites.google.com/site/fesherierjojkoqdr/partie-i-les-caracteristiques-des-batteries-li-ion/fonctionnement
- https://en.wikipedia.org/wiki/Lithium-ion_battery
- https://www.elektronik-kompendium.de/sites/bau/0810281.htm