(C) MOAST
Différentes substances, telles que les liquides dans la vidéo, présentent la propriété remarquable de rayonner. Ce phénomène s’appelle luminescence (voir Infobox), dans notre cas plus précisément fluorescence. Mais pourquoi ces liquides sont lumineux?
La lumière émise n’est rien d’autre qu’une forme d’énergie. Or, l’énergie ne sort pas du néant: Elle est fournie en fin de compte par des lampes UV („blacklight“), qui excitent des colorants spéciaux dans les liquides et les incitent ainsi à rayonner.
Mais que signifie « exciter » et comment ça fonctionne avec l’énergie en détail?
Pour pouvoir comprendre ce phénomène plus en détail, jettons un coup d’œil sur les plus petites particules constitutives de la matière : les atomes.
C’est quoi un atome?
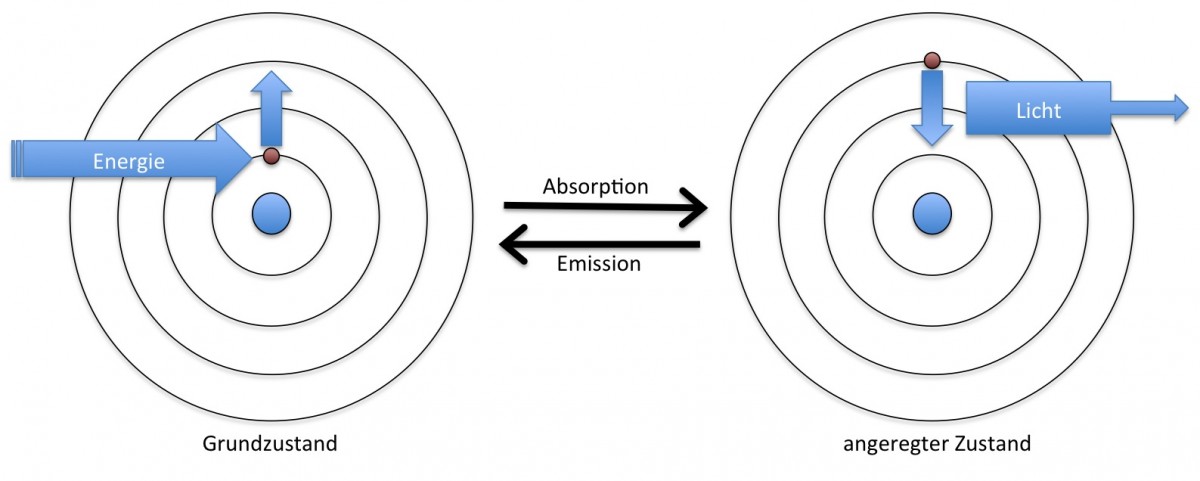
Un atome (simplifié) est constitué d’un noyau chargé positivement, qui renferme presque toute la masse de l’atome, autour duquel gravitent sur des couches bien définies les électrons chargés négativement. L’énergie de l’électron ne dépend que da la distance de sa couche par rapport au noyau: Plus il est éloigné du noyau, plus il porte de l’énergie (comme pour un élastique: plus on l’étire, plus il renferme de l’énergie).
Des atomes « excités » rayonnent!
Normalement les électrons se trouvent aussi proches du noyau que possible (le nombre d’électrons sur une couche donnée est strictement défini). Si un électron absorbe de l’énergie (par lumière, courant électrique, chaleur) il peut être catapulté sur une couche plus éloignée. On dit que l’électron est alors dans un état excité. Cet état est instable et ainsi l’électron retombe dans son état fondamental (comme pour l’élastique: Dès que l’on arrête de l’étirer, il se rétrécit dans son « état initial »). L’énergie gagnée auparavant est alors libérée sous forme de lumière. C’est ainsi que fonctionnent les lampadaires jaunes sur les autoroutes: Par excitation électrique des électrons d’atomes de sodium passent sur une couche supérieure de laquelle ils retombent très vite en émettant une lumière jaune caractéristique.
De l’atome à la molécule.
Un ensemble délimité et strictement défini d’atomes s’appelle molécule. Tout le monde en connaît des exemples comme p.ex. la molécule d’eau constituée d’un atome d’oxygène et de deux atomes d’hydrogène.
Les molécules aussi sont « excitables » !
Dans des molécules données (comme p.ex. les colorants de la vidéo), tout comme dans les atomes isolés, des électrons peuvent passer de l’état fondamental à l’état excité, même si ceci s’avère plus difficile à illustrer que dans le cas des atomes. Dans des conditions bien définies cette rechute vers l’état fondamental peut provoquer l’émission d’une lumière caractéristique. Si les électrons retombent quasiment instantanément de l’état excité, on parle de fluorescence. Elle s’arrête net si l’excitation cesse : Le marqueur ne brille pas dans le noir. Les substances de la vidéo (fluorescéine et rhodamines) sont fluorescentes grâce aux rayons énergétiques des lampes UV. D’autres molécules ne cèdent cette énergie que lentement (parfois pendant des heures). Dans ce cas on parle de phosphorescence. C’est p.ex. le cas pour les étoiles lumineux pour la chambre d’enfant ou pour les aiguilles luminescentes de montres.
Auteur: Jerry Wagener
Vidéo: Moast
Infobox
Il faut bien faire la différence si une réaction chimique est responsable pour le rayonnement (comme p.ex. pour les bâtons lumineux ou la luciole) ou non. Dans le premier cas, on parle de chimiluminescence respectivement bioluminescence (chimiluminescence dans un système biologique), dans le deuxième cas de fluorescence et de phosphorescence (voir article). Pour ces dernières il n’y a pas de transformation de matière, on parle d’un phénomène physique (comme p.ex. le transport d’un courant électrique à travers un fil électrique : le fil n’est pas altéré par le passage du courant).