shotshop.com
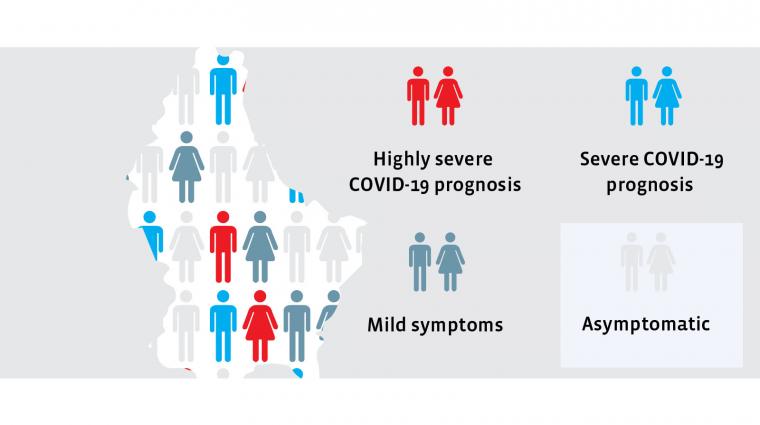
L’évolution de la maladie sur des personnes testées positives au Sars-CoV-2 est très différente d’une personne à l’autre. Certaines personnes ne remarquent absolument aucun symptôme, pour de nombreuses autres personnes, l’évolution de la maladie est bénigne, pour d’autres encore, beaucoup plus grave, sans pour autant devoir se rendre à l’hôpital. Et enfin, certains patients doivent être soignés à l’hôpital ou même en soins intensifs. C’est cette affluence vers les soins intensifs qui met les systèmes de santé à genoux.
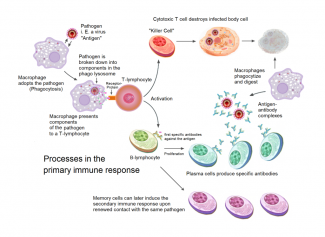
Que se passe-t-il dans le corps lors d’une infection au Sars-CoV-2 ? Quelle est précisément la maladie Covid-19 ?
Les patients développant une forme grave de la maladie ne se battent pas seulement contre le virus mais aussi contre eux-mêmes. Contre leur propre système immunitaire. En effet, plonger le système immunitaire dans le chaos, c’est ce qui caractérise la maladie proprement dite qui déclenche le nouveau coronavirus Sars-CoV-2. Bien que les patients en soins intensifs aient un tas d’anticorps dans le sang, ils n’arrivent pas à prendre le contrôle sur l’infection. Parmi ces patients, certains vont mourir, d’autres souffriront encore pendant des mois, voire des années, des suites de la maladie. Comment est-ce possible ?
Dans cet article, nous essayons de répondre plus en détail à quelques questions concernant la réponse immunitaire au Sars-CoV-2 et les différentes évolutions de la Covid-19. Afin de présenter cet article de façon claire, nous avons structuré chaque question sous forme de petite boîte dépliable. N’hésite pas à nous donner ton avis sur cette présentation dans le sondage à la fin de l’article.
Auteur : Cornelia Eisenach (Scitec Media)
Editeurs : Jean-Paul Bertemes (FNR), Michèle Weber (FNR)
Illustration : me=Sciencia58 an the makers of the single images Domdomegg, [1], Fæ, Petr94, Manu5 via Wikimedia Commons, CC-BY-SA-4.0