© shotshop
Das Protein mit dem Namen DJ-1 spielt beim Erhalt funktionsfähiger Nervenzellen eine entscheidende Rolle. Ist der Körper nicht in der Lage, DJ-1 in ausreichendem Maße zu produzieren, sterben wichtige Nervenzellen ab. In der Folge entwickeln sich neurodegenerative Erkrankungen, wie zum Beispiel die Parkinsonkrankheit. Die Produktion von so wichtigen Proteinen, wie dem DJ-1-Protein, kann gestört oder ganz unterbunden werden, wenn der genetische Bauplan oder der daran geknüpfte Produktionsprozess defekt ist.
Protein wird durch Defekt gar nicht erst gebildet
Ein interdisziplinäres Forscherteam des Luxembourg Center for Systems Biomedicine (LCSB) der Universität Luxemburg hat unter der Leitung von Prof. Dr. Rejko Krüger hat nun erstmals die Bedeutung eines Fehlers im Produktionsprozess, dem sogenannten „Splicing“, als maßgeblich für die Entwicklung einer bestimmten Form der Parkinsonerkrankung identifizieren können. „Ein wesentliches Werkzeug für die Montage des Proteins DJ-1 kann bei den Patienten nicht richtig andocken“, erklärt Krüger. „In der Wissenschaft sprechen wir hier als Folge des Problems vom Exon-Skipping. Das Protein wird durch den Defekt gar nicht erst gebildet.“
Das Forschungsergebnis bietet einen völlig neuen Angriffspunkt bei der medikamentösen Behandlung dieser Fehlfunktion der Protein-Synthese. „Diese Erkenntnis verändert den Blick auf die Ursachen der Erkrankung fundamental und bietet völlig neue Möglichkeiten bei der Behandlung“, sagt Dr. Ibrahim Boussaad, leitender Wissenschaftler und Erstautor der wissenschaftlichen Publikation. „Unser neues Verständnis konnten wir alleine dadurch generieren, dass wir mit Spenden von Hautzellen der betroffenen Patienten gearbeitet haben“, hebt Boussaad hervor.
Hautzellen werden umprogrammiert
Die 2015 initiierte Luxemburger Parkinson Studie beinhaltet eine Gruppe von 800 Parkinson-Patienten und 800 gesunden Vergleichspersonen. Durch die Spende von Hautzellen, die mittels einer kleinen Biopsie entnommen werden, ist es den Forschern in Luxemburg möglich, diese Zellen im Reagenzglas „umzuprogrammieren“ und aus ihnen Nervenzellen zu erzeugen. Diese Nervenzellen - und das ist das Besondere – bilden die Nervenzellen des jeweiligen Spenders in betroffenen Hirnregionen nach und können dann im Labor für Analysen und Tests genutzt werden.
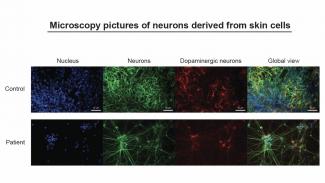
Da die Entnahme von Nervenzellen aus dem Gehirn von Patienten aus gesundheitlichen und ethischen Gründen nicht möglich ist, lässt sich so – über den Umweg der Reprogrammierung – dennoch das Krankheitsbild an patienteneigenen Nervenzellen im Reagenzglas untersuchen. Die Wissenschaft spricht in diesem Fall von einem patientenbasierten In-vitro-Modell und einem wichtigen Schritt bei der personalisierten Medizin.
Wirkstoffe Phenylbuttersäure und RECTAS ermöglichen Regeneration
Das Team um Krüger konnte auf diese Weise die eigentliche Ursache für die genetische Form der Parkinsonerkrankung, bei der das PARK-7-Gen eine Mutation aufweist, aufklären. „Wir freuen uns, dass wir zu dieser Stammzell-Arbeit der Kolleginnen und Kollegen in Luxemburg mit unserer Expertise in der Reprogrammierung von Patienten-Zellen beitragen konnten“, sagt Prof. Dr. Thomas Gasser, Ärztlicher Direktor am Universitätsklinikum Tübingen und Co-Autor der Publikation. Insgesamt haben Institutionen aus Deutschland, Italien und den USA im Forschungsprojekt mitgearbeitet.
Mithilfe der Entwicklung präziser bioinformatischer Algorithmen am LCSB konnte umgehend eine automatisierte Recherche nach potenziellen Wirkstoffen für eine medikamentöse Behandlung erfolgen. Das Forscherteam stieß dabei auf die Wirkstoffe Phenylbuttersäure und RECTAS (RECTifier of Aberant Splicing). Beide Wirkstoffe - in Kombination verabreicht - ermöglichen den Zellen im Reagenzglas eine wirksame Regeneration der Produktion des so wichtigen Proteins DJ-1.
Alle notwendigen wissenschaftlichen Disziplinen vereint
„Nur durch Verknüpfung zahlreicher Disziplinen - von der Arbeit der Ärzte über die Forschung im Labor bis zu den Computerwissenschaften – war es uns an der Universität Luxemburg möglich, die Ursache zu analysieren und zugleich die Wirkstoffe zu identifizieren, die eine medikamentöse Behandlung ermöglichen“, erläutert Krüger und ergänzt: „Da wir seit einigen Jahren alle nötigen Disziplinen in Luxemburg vereint haben, ist ein derartiger wissenschaftlicher Fortschritt „Made in Luxembourg“ möglich.“ Die Arbeit stellt den bisherigen Höhepunkt des durch den FNR geförderten PEARL-Programms dar, über welches die Arbeit von Krüger und dessen Team gefördert wird. Großen Wert legt das Team der Wissenschaftler darauf, den Teilnehmern der Studie zu danken. Die Ergebnisse des Forschungsprojekts wurden im wissenschaftlichen Fachjournal ‚Science Translational Medicine’ veröffentlicht.
Mehr Informationen, auch über die Teilnahme an weiteren Studien, gibt es unter parkinson.lu.
Autor: University of Luxemburg
Editor: Uwe Hentschel