Divya Balakrishnan
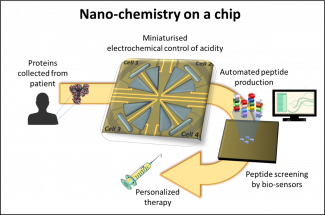
Schematische Darstellung der Entwicklung einer personalisierten Therapie mittels Nanochemie auf einem Chip
In den letzten Jahren haben wir immer schnellere Fortschritte in der personalisierten Medizin erlebt. Das Endziel ist es, jedem*jeder Patient*in eine Behandlung anzubieten, die auf die individuellen Eigenschaften seines*ihres Körpers und seiner*ihrer Erkrankung zugeschnitten ist. Elemente der personalisierten Medizin spielen bereits eine Rolle bei der Behandlung von Krebspatient*innen und haben bei einigen von ihnen die klinischen Ergebnisse verändert. Die weitere Entwicklung personalisierter Behandlungen wird jedoch durch mehrere technologische Herausforderungen gehemmt.
Eine solche Herausforderung ist die Fähigkeit, viele therapeutische Moleküle zu screenen, um den optimalen Kandidaten für eine Krebsbehandlung zu identifizieren. Divya Balakrishnan und ihre Kolleg*innen vom Luxembourg Institute of Science and Technology (LIST) haben ein elektrochemisches Gerät im Nanomaßstab erfunden, das diesen Prozess erleichtern könnte. Das Gerät steuert automatisch den Säuregehalt in Mikroreaktoren (in sehr kleinen Mengen auf einem Chip), was es den Wissenschaftler*innen ermöglicht, eine große Anzahl von therapeutischen Kandidaten schnell und in kleinem Maßstab aufzubauen und zu screenen. Dies könnte eine Lösung für eines der Hindernisse auf dem Weg zu bezahlbaren personalisierten Therapien für Krebspatient*innen sein.
Divyas gesamte Arbeit ist in ihrer Dissertation „Acidity control in miniaturized volumes: engineered microreactors for high throughput chemical reactions“ beschrieben, die in die engere Wahl für den FNR-Award 2020 in der Kategorie „Hervorragende Doktorarbeit“ gekommen ist.
Wie kann eine personalisierte Krebstherapie mithilfe von Nanochemie auf einem Chip hergestellt werden?
Eine mögliche Krebstherapie, die mithilfe der Nanochemie auf einem Chip entwickelt werden könnte, ist ein therapeutischer Krebsimpfstoff. Anders als ein prophylaktischer Impfstoff, der davor schützt, sich mit einer Infektionskrankheit anzustecken, ist dies eine Behandlung, die das eigene Immunsystem der Patient*innen dazu anregen könnte, ihre Krebszellen anzugreifen und zu eliminieren. Da Krebszellen mutierte Versionen unserer gesunden Zellen sind, können sie andere Proteine produzieren als die gesunden Zellen. Proteine sind große, komplexe Moleküle, die viele wichtige Funktionen in unserem Körper haben und aus kleineren Einheiten, den Peptiden, bestehen. Die Analyse dieser Peptide in den Krebszellen aller Patient*innen könnte den Ärzt*innen helfen, die besten Kandidaten für einen therapeutischen Impfstoff auszuwählen.
Die Methoden, die derzeit zur Auswahl der potenziell therapeutischen Peptide verwendet werden, sind aufwändig, teuer und nicht sehr effizient. Die von Divya erfundene Technologie macht diesen Prozess schneller, zuverlässiger und billiger, weil er mit einem hohen Durchsatz und in kleinem Maßstab durchgeführt werden kann. Mit ihrem elektrochemischen Gerät, das den Säuregrad automatisch anpasst, werden Peptide auf der Basis von aus dem*der Patient*in isoliertem Proteinmaterial aufgebaut. Die Peptide werden von einem Bio-Sensor gescreent, der die besten Kandidaten für einen Impfstoff auswählt, der dann zur Behandlung der Patient*innen eingesetzt werden kann.
Warum ist es wichtig, den Säuregrad beim Aufbau von Molekülen zu kontrollieren?
Der Aufbau von Molekülen, wie z. B. DNA, Proteinen oder Peptiden, ist abhängig von einem bestimmten Säuregrad, dem pH-Wert. Je schneller und genauer der Säuregrad eingestellt wird, desto effizienter wird die Produktion der Moleküle. Aus diesem Grund ist die Kontrolle des Säuregrads entscheidend für die kombinatorische Chemie, d. h. die schnelle Herstellung einer großen Anzahl chemischer Verbindungen in kleinem Maßstab in einem einzigen Verfahren. In einem einfachen Experiment kann der Säuregrad in einem Glas Wasser kontrolliert werden, indem man abwechselnd Tropfen einer Säure (wie Zitronensaft oder Essig) hinzufügt, um den pH-Wert zu senken, und Tropfen einer Base (wie Chlorbleiche), um den pH-Wert zu erhöhen. Da die Erzeugung eines Moleküls aus mehreren Schritten besteht und jeder dieser Schritte einen anderen pH-Wert erfordern kann, kann man sich vorstellen, dass das Einstellen des Säuregrads bei der Herstellung von Molekülen in großem Maßstab ziemlich mühsam wird. Auch bei kleineren Reaktionsvolumina wird es zunehmend schwieriger. Genau das macht die Technologie der automatischen Säureregelung in Mikroreaktoren (die weniger als einen halben Millimeter groß sind) bahnbrechend. Divya erklärt das so: „Wir haben bewiesen, dass mehrere dieser Mikroreaktoren gleichzeitig auf einem Chip arbeiten können, der kleiner als eine Fünf-Cent-Münze ist, und den größten Säuregradbereich aller derzeit verfügbaren elektrochemischen Geräte bieten.“
Was sind die möglichen Anwendungen der automatisierten Säuregradsteuerung in der Zukunft?
Divya Balakrishnan ist Teil eines Teams aus Materialwissenschaftler*innen, Chemiker*innen, Immunolog*innen und Informatiker*innen, die innerhalb eines von der EU geförderten Netzwerks namens Electromed mit Kolleg*innen aus anderen europäischen Forschungseinrichtungen zusammenarbeiten. Im Mittelpunkt dieser breit angelegten Zusammenarbeit steht die Entwicklung einer Technologie der nächsten Generation, welche die personalisierte Medizin weiter voranbringen würde. Divya: „Laut einem Bio-Pharma-Artikel lagen die Kosten für die Entwicklung eines neuen Medikaments im letzten Jahrzehnt bei etwa einer Milliarde US-Dollar, wobei die höchsten Kosten bei Krebs- und Immunologie-Medikamenten anfielen. Und das fast 30 Jahre nach der Einführung der kombinatorischen Chemie. Es besteht eindeutig ein Bedarf an neuen innovativen Lösungen, die den aktuellen Anforderungen gerecht werden können. Ich bin fest davon überzeugt, dass eine davon unsere Nanochemie auf einem Chip sein wird, die zuverlässige, kosten- und zeiteffiziente maßgeschneiderte Behandlungen bietet, die wir hier in Luxemburg entwickelt haben.“
Die zusätzliche Stärke dieser Technologie ist, dass sie, wenn sie sich als so effektiv und zuverlässig erweist, wie die Forscher*innen hoffen, auch für andere Bereiche, wie die Lebensmittelindustrie und Umweltwissenschaft, interessant werden könnte.
Autorin : Anna Keller
Editorin : Michèle Weber (FNR)
Illustration: Divya Balakrishnan (LIST)