© sudok1/Shotshop.com
Die Analyse der genetischen Merkmale eines Tumors kann dabei helfen, das Medikament zu identifizieren, gegen das er möglicherweise empfindlich ist
Krebszellen weisen eine große genetische Vielfalt auf. Und das auch innerhalb der Tumore eines Patienten. Dementsprechend unterscheiden sich auch die molekularen Abläufe im Inneren. Auf Medikamente reagieren diese Zellen deshalb auch unterschiedlich. Was dazu führt, dass sie trotz medikamentöser Behandlung überleben und sich die Krankheit so weiterentwickeln kann.
Für jeden Patienten das Medikament, das bei seinem Krebs auch am besten wirkt
Die Analyse der genetischen Merkmale eines Tumors kann dabei helfen, das Medikament zu identifizieren, gegen das er möglicherweise empfindlich ist. Das Problem: Derzeit funktioniert das nur bei einer vergleichsweise geringen Zahl an Patienten. Wissenschaftler aus Luxemburg wollen die Erfolgsquote nun deutlich erhöhen. Unter der Leitung des Luxembourg Institute of Health (LIH) soll nach Beendigung einer derzeit laufenden Pilotstudie eine Studie mit Patienten aus Luxemburg starten. Diese zielt darauf ab, eine direktere Methode, genannt „Personalised Functional Profiling“, zur individuellen Anpassung von Krebstherapien zu entwickeln.
Bei diesem Projekt wenden die Wissenschaftler eine neue Methode an, um Tumorprofile mit Behandlungen abzugleichen. Sie wollen herauszufinden, auf welche Medikamente die Tumorzellen reagieren. Ziel der Studie ist es, am Ende jedem Patienten von den auf dem Markt erhältlichen Krebsmedikamenten jenes zu verabreichen, auf das der Tumor am besten reagiert.
Ursprüngliche Struktur und Profil des Tumors wird möglichst exakt nachgeahmt
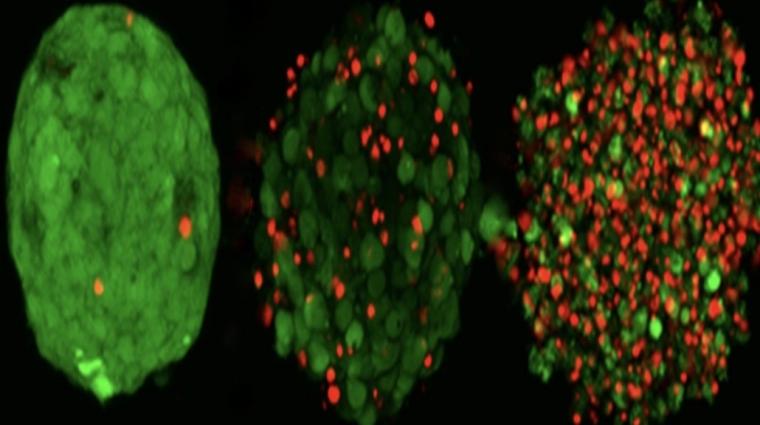
Um das zu erreichen, kommt ein 3D-Drucker zum Einsatz. Genau genommen handelt es sich um einen 3D-Bioprinter. Dieser ermöglicht das dreidimensionale Drucken von Zellverbünden, sogenannten Krebs-Nanosphäroiden, aus dem Patiententumor.
Der durch eine Biopsie entnommene Zellverbund wird dabei auf eine Unterlage mit einem Raster aus vielen kleinen Säulen gedruckt. Das Besondere ist, dass auf jede dieser Säulen die gleiche Menge an Zellen gedruckt wird. Die Ausgangslage ist also überall dieselbe. Und um die ursprüngliche Struktur und das Profil des Tumors so genau wie möglich nachzuahmen, werden - im Gegensatz zu herkömmlichen Zellkulturverfahren - die Krebszellen nach der Entnahme aus dem Tumor nicht voneinander getrennt.
„Die ursprüngliche Nähe zu Nachbarzellen oder Bindegewebszellen geht nicht verloren“, sagt Professor Ulf Nehrbass, Direktor des LIH und Koordinator der Studie. „Dies erhöht die Zuverlässigkeit der Methode und unterscheidet sie von früheren Ansätzen“, erklärt der Forscher.
Bestimmung der Wirksamkeit eines Medikaments soll den Spendern von Biopsien direkt zugutekommen
Im nächsten Schritt werden diese kaum tropfengroße Zellverbünde mit Krebsmedikamenten in Verbindung gebracht. Dabei kommen 42 verschiedene Medikamente in sieben verschiedenen Dosen zum Einsatz. Unterm Strich werden also 284 Varianten von Medikamenten und Konzentrationen untersucht und entsprechend visualisiert. Die Forscher können dann anhand der Daten erkennen, welches Medikament in welcher Dosis beim jeweiligen Krebsbefund am besten wirkt.
Die Bestimmung der Wirksamkeit eines Medikaments soll den Spendern von Biopsien direkt zugutekommen, wie Nehrbass erklärt: „Wir werden die Informationen an die behandelnden Ärzte weitergeben. Sie werden dann entscheiden, ob der Patient eine weitere Behandlung erhalten soll, die möglicherweise nicht zu den Standardbehandlungsoptionen des jeweiligen Krebstyps gehört.”
Standardbehandlungen blieben bei Pilotstudienteilnehmer ohne Erfolg
Unter Berücksichtigung aller medizinischen und ethischen Gesichtspunkte sei dies definitiv eine in Betracht zu ziehende Option, meint der Mediziner. Die Patienten der Pilotstudie, von denen die entnommenen Gewebeproben stammten, seien bereits allen Standardbehandlungen und -therapien unterzogen worden – leider aber ohne Erfolg.
„Aus heutiger Sicht sind wir der Meinung, dass unser Ansatz zur Entwicklung personalisierter Krebstherapieoptionen beitragen kann“, sagt Nehrbass, der sich von der Studie einen bedeutenden Beitrag zur Krebstherapie erhofft, gelichzeitig aber auch vor zu hohen Erwartungen warnt: Die Entwicklung werde lange dauern und könne unter Umständen auch scheitern. „Selbst im Idealfall würde es wahrscheinlich nicht bei jedem Patienten und bei jedem Krebs helfen“, sagt Nehrbass. „Aber wir werden es versuchen.“
Schwerpunkt der Studie sind Magen-Darm Krebs und Glioblastom, eine Form des Hirntumors
Bis es soweit ist, haben die Wissenschaftler allerdings noch einen weiten Weg vor sich. Der erste Schritt der Pilotstudie besteht darin, standardisierte Methoden an den Zellverbünden von fünf bis sechs Patienten zu testen, um so die Durchführbarkeit und Zuverlässigkeit der Methode zu bestimmen. Danach, wahrscheinlich 2020 oder 2021, kann die eigentliche klinische Studie, für die derzeit in Luxemburg ein Labor eingerichtet wird, mit einer größeren Anzahl von Patienten und in Zusammenarbeit mit internationalen Partnern beginnen.
Schwerpunkt der Studie, die in Zusammenarbeit mit dem Centre Hospitalier de Luxembourg (CHL), den Hopitaux Robert Schuman (HRS) und demLaboratoire national de santé (LNS) konzipiert wurde, ist zum einen der Glioblastom, ein bestimmter Typ von Hirntumor, sowie Magen-Darm-Krebs. An der voraussichtlich zweijährigen Studie sollen bis zu 20 Patienten ab 18 Jahren teilnehmen, die an einer dieser beiden Krebsformen leiden.
Autor: LIH, Uwe Hentschel