© sudok1/Shotshop.com
L’analyse des caractéristiques génétiques d’une tumeur peut contribuer à identifier le médicament auquel elle sera potentiellement sensible
Les cellules cancéreuses présentent une grande diversité génétique,ce également au sein des tumeurs d’un même patient. Par conséquent, les processus moléculaires qui les sous-tendent sont également différents. Ces cellules réagissent donc différemment aux médicaments. Malgré le traitement médicamenteux, celles-ci parviennent donc à survivre et la maladie continue de se développer.
À chaque patient le médicament qui agit le mieux contre son cancer
L’analyse des caractéristiques génétiques d’une tumeur peut contribuer à identifier le médicament auquel elle sera potentiellement sensible. Le problème est que cela ne fonctionne actuellement que pour un nombre comparativement faible de patients. Les scientifiques du Luxembourg visent désormais à augmenter sensiblement le taux de réussite. Sous la direction du Luxembourg Institute of Health (LIH), une étude avec des patients du Luxembourg va être lancée à l’issue d'une étude pilote encore en cours. Cette nouvelle étude vise à développer une méthode plus directe, dite « Personalised Functional Profiling », soit un ajustement individuel des traitements du cancer.
Les scientifiques appliqueront dans le cadre de ce projet une nouvelle méthode pour rapprocher les traitements des profils de tumeurs. Ils souhaitent trouver à quels médicaments les cellules cancéreuses réagissent. L’objectif de cette étude est au final de pouvoir administrer à chaque patient le médicament anticancéreux, parmi ceux disponibles sur le marché, auquel sa tumeur réagit le mieux.
La structure et le profil d’origine de la tumeur seront imités le plus exactement possible
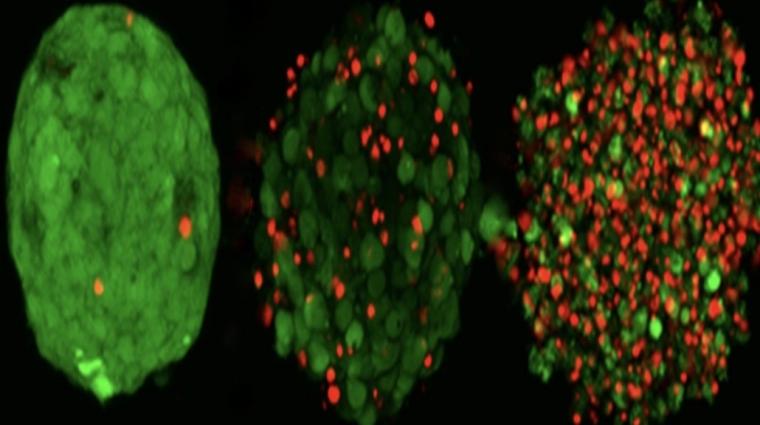
Pour y parvenir, nous utilisons une imprimante 3D. Pour être plus précis, il s’agit en l’occurrence d’une bio-imprimante 3D capable d’imprimer en trois dimensions des ensembles cellulaires de la tumeur du patient, appelées nanosphéroïdes du cancer.
L’ensemble cellulaire prélevé par biopsie est imprimé sur un support à l’aide d’une trame composée de nombreuses petites colonnes. La particularité réside dans le fait que la même quantité de cellules est imprimée sur chacune de ces colonnes. La situation initiale est donc la même partout. Afin de reproduire le plus exactement possible la structure et le profil d’origine de la tumeur, les cellules cancéreuses ne sont pas dissociées de la tumeur après le prélèvement, contrairement aux procédés classiques de cultures de cellules.
« La proximité initiale avec les cellules voisines ou les cellules du tissu conjonctif n’est pas perdue », déclare le directeur du LIH et coordinateur de l’étude, professeur Ulf Nehrbass. « Ceci accroît la fiabilité de la méthode et la distingue des approches antérieures », explique le chercheur.
La détermination de l’efficacité d’un médicament doit directement bénéficier aux patients ayant subi la biopsie
L’étape suivante consiste à mettre en contact ces ensembles de cellules de la taille d’une goutte à peine avec des médicaments anticancéreux. 42 médicaments différents sont utilisés à cet effet selon sept dosages différents. Au final, 284 variantes de médicaments et de concentration sont ainsi étudiées et visualisées de cette façon. Les chercheurs peuvent alors voir à partir des données recueillies quel médicament est le plus efficace pour le cancer constaté, et à quel dosage.
La détermination de l’efficacité d’un médicament doit directement bénéficier aux patients ayant subi la biopsie, tel que M. Nehrbass l’explique : « Nous transmettrons les informations aux médecins traitants auxquels il revient de décider si le patient doit subir un autre traitement ne faisant éventuellement pas partie des options de traitement standard pour le type de cancer du patient. »
Les traitements standard sont restés sans succès pour les participants à l’étude pilote
Au regard de tous les points de vue éthiques et médicaux, ceci constitue très clairement une option qui mérite d’être prise en compte, défend le médecin. Les patients de l’étude pilote auxquels les prélèvements de tissus appartenaient avaient déjà subi tous les traitements et toutes les thérapies standard, malheureusement sans succès.
« Du point de vue actuel, nous sommes d’avis que notre approche peut contribuer au développement d’options thérapeutiques personnalisées contre le cancer », déclare M. Nehrbass, qui, pour autant qu’il espère que l’étude apporte une contribution majeure à la thérapie anticancéreuse, préfère mettre en garde contre des attentes trop élevées : le développement va prendre du temps et pourrait ne pas aboutir. « Même si tout se passe bien, cela ne pourrait probablement pas aider chaque patient et s’appliquer à chaque cancer », prévient-il. « Mais nous allons essayer. »
L’étude cible principalement le cancer gastro-intestinal et le glioblastome, une forme de tumeur cérébrale
Les scientifiques ont encore un long chemin à parcourir avant que tout soit prêt. La première étape de l’étude pilote consiste à tester sur les ensembles cellulaires de cinq ou six patients les méthodes standardisées, ce qui permettra d’explorer la faisabilité et la fiabilité de la méthode. Puis, probablement en 2020 ou en 2021, pourra commencer l’étude clinique à proprement parler, pour laquelle un laboratoirae est en train d’être créé au Luxembourg. Ceci permettra d’impliquer un nombre plus important de patients avec la coopération de partenaires internationaux.
Cette étude, née d’une coopération entre le Centre Hospitalier de Luxembourg (CHL), les Hôpitaux Robert Schuman (HRS) et le Laboratoire national de santé (LNS), est principalement axée d’une part sur le glioblastome, un type particulier de tumeur cérébrale, et d’autre part sur le cancer gastro-intestinal. Cette étude, qui durera probablement deux ans, impliquera la participation d’un maximum de 20 patients de plus de 18 ans souffrant de l’une de ces deux formes de cancer.
Auteur : LIH, Uwe Hentschel