© LIH
Darstellung der verschiedenen Populationen von Immunzellen in der Milz von Mäusen, die mit einer Technik namens Massenzytometrie generiert wurde.
Einem Forscherteam des Luxembourg Institute of Health (LIH) ist es gelungen, auf Zellebene die Umgebung zu charakterisieren, in der sich die chronische lymphatische Leukämie entwickelt, ein Blutkrebs, von dem hauptsächlich Erwachsene über 50 betroffen sind. Dank dieser umfassenden Untersuchung der gesunden Zellen in unmittelbarer Nähe der Tumorzellen war es möglich, potenzielle Behandlungen auszuwählen und in präklinischen Studien zu testen.
Die Ergebnisse deuten darauf hin, dass eine zweifache Behandlung mit Antikörpern die Krankheitsentwicklung in Tiermodellen (Mäusen) wirksam hemmen kann und somit eine neue Behandlungsstrategie darstellen könnte.
Tumorzellen bauen um sich herum eine schützende Mikroumgebung auf
Die chronische lymphatische Leukämie (CLL) ist eine Blutkrebserkrankung, die in den Stammzellen des Knochenmarks entsteht und sich durch den Blutkreislauf auf andere Organe ausbreitet. Diese Krebsart hat einen langsamen Verlauf und kann mehrere Jahre ohne erkennbare Symptome verharren. Die Krankheit ist derzeit nicht heilbar, durch verschiedene Behandlungen kann aber die Lebenserwartung verlängert werden.
CLL entwickelt sich nur in einer Umgebung, die das Tumorwachstum begünstigt. Wenn die Tumorzellen in ein Gewebe eindringen, kommen sie mit gesunden Zellen, beispielsweise Zellen des Immunsystems, in Kontakt. Damit sie weiter wachsen können, bauen die Tumorzellen um sich herum eine schützende Mikroumgebung auf, in der die Verteidigungsmechanismen des Immunsystems gehemmt werden.
Komplexes Zusammenspiel von Zellen
Da die Tumor-Mikroumgebung bei dieser Krebsart noch nicht eingehender untersucht wurde, haben die Forscher des „Laboratory of Experimental Cancer Research“ am LIH Experimente zur Analyse von Immunzellpopulationen in der Umgebung der Tumorzellen durchgeführt. Diese Experimente erfolgten an Tiermodellen unter strikter Einhaltung der nationalen und europäischen Vorschriften. Durch den Vergleich von Proben aus der Milz von kranken Mäusen mit denen von gesunden Mäusen haben die Forscher festgestellt, dass die vorhandenen Krebszellen eine umfangreiche Neuorganisation der verschiedenen Typen und Untertypen von Immunzellen bewirkt hatten.
Die Tumor-Mikroumgebung enthält nämlich eine größere Menge an Immunzellen, die eine regulatorische Funktion haben und die Immunantwort hemmen. Die Wissenschaftler haben auch beobachtet, dass zahlreiche Zelltypen an ihrer Oberfläche eine große Zahl von Molekülen aufwiesen, die als Kontrollpunkt des Immunsystems („immune checkpoint“) wirken.
Therapie mit zwei Antikörpern
Auf der Grundlage dieser neuen Erkenntnisse wollten die Forscher die Wirksamkeit verschiedener Immuntherapien testen, das heißt von Behandlungen, die die Verteidigungsmechanismen des Immunsystems gegen den Krebs wieder aktivieren und stärken. Die Wirkstoffe sind Antikörper, die gezielt die Immun-Kontrollpunkte an der Oberfläche der Zellen erkennen.
In seinen Tests mit mehreren Antikörpern zur Einfach- und Zweifachbehandlung bei Mäusen hat das Team festgestellt, dass nur das gleichzeitige „Targeting" von zwei bestimmten Immun- Kontrollpunkten (genannt PD1 und LAG3) das Tumorwachstum wirksam blockieren konnte. Diese zweifache Behandlung ist in der Lage, die Zusammensetzung der Immunzellen in der Mikroumgebung des Tumors zu verändern. Die Behandlung bewirkt eine Anreicherung mit sogenannten „Effektorzellen“ des Immunsystems, die Krebszellen angreifen können. Außerdem verringert sie den Überschuss an regulatorischen Zellen, die die Immunantwort blockieren.
„Unsere präklinische Studie ist ein bedeutender Fortschritt in der Leukämieforschung“, erklären Dr. Etienne Moussay und Dr. Jérôme Paggetti, die das Projekt geleitet haben. „Mit ihr konnten wir neue Erkenntnisse über das Wesen der Tumor-Mikroumgebung gewinnen und – was noch wichtiger ist – eine neue Behandlungsstrategie vorschlagen und deren Wirkungsweise verstehen. Diese zweifache Behandlung kann nun in klinischen Versuchen mit intravenöser Verabreichung an Menschen getestet werden.“
Autor: LIH
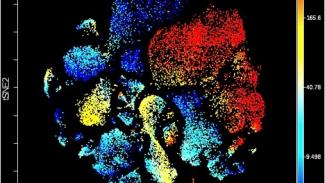
Bild: LIH (Auszug aus einer grafischen 2D-Darstellung der Verteilung von Immunzellen in der Milz von Mäusen (in diesem Fall, CD4+ T-Lymphozyten), die mit einer Technik namens Massenzytometrie und auf Basis eines Algorithmuses generiert wurde. In rot die Regionen wo die Expression des Oberflächenmarkers CD4 und somit die Präsenz von CD4+ T-Lymphozyten am höchsten ist, in blaue die Regionen wo sie am niedrigsten ist).
Infobox
Die Studie, die hauptsächlich von der Doktorandin Marina Wierz durchgeführt und von Dr. Etienne Moussay und Dr. Jérôme Paggetti betreut wurde, ist eine Kooperation zwischen verschiedenen Forschungsabteilungen des LIH: dem „Laboratory of Experimental Cancer Research“ und dem „NorLux Neuro-Oncology Laboratory“ im „Department of Oncology“ sowie der „National Cytometry Platform“, die zum „Department of Infection and Immunity“ gehört. Das Projekt wurde durch Fördermittel von FNRS Télévie, des luxemburgischen „Fonds National de la Recherche“ (FNR) und der Europäischen Union (FEDER) sowie internen Finanzierungen unterstützt.
Die Ergebnisse dieser Forschung sind in der angesehenen wissenschaftlichen Fachzeitschrift „Blood“ in der Ausgabe von April 2018 frei zugänglich.
Dr. Etienne Moussay
Department of Oncology
Luxembourg Institute of Health
E-mail: etienne.moussay@lih.lu
Dr. Jérôme Paggetti
Department of Oncology
Luxembourg Institute of Health
E-mail: jerome.paggetti@lih.lu
Verfügbarkeit für Interviews: auf Anfrage bei der Kommunikationsabteilung
Juliette Pertuy
Kommunikationsmanager
Luxembourg Institute of Health
Tel: +352 26970-893
E-mail : juliette.pertuy@lih.lu
Dr. Malou Fraiture
Scientific writer
Luxembourg Institute of Health
Tel: +352 26970-895
E-Mail : malou.fraiture@lih.lu