AdobeStock/nobeastsofierce
Illustration von stäbchenförmigen Bakterien. Genetische Mutationen von Bakterien (hier durch eine Farbänderung angezeigt) können zu einer Resistenz gegen Antibiotika führen.
Der WHO zufolge bedroht die Antibiotikaresistenz die weltweite Gesundheit und „erfordert dringende Maßnahmen“. Für die Europäische Union handelt es sich dabei um eine der drei größten Bedrohungen für die allgemeine Gesundheit. Ein wichtiger Hebel ist die Senkung des Verbrauchs, sowohl in der Human- als auch in der Tiermedizin. Haben die Anstrengungen Früchte getragen, und ist es zu einem Rückgang der Resistenzen gekommen? Könnten bald neue Moleküle zur Verfügung stehen, um resistente Bakterien zu bekämpfen?
Wir fassen hier zusammen, was die Wissenschaft derzeit weiß: Über den Verbrauch von Antibiotika in Luxemburg und weltweit, über die Entwicklung von Resistenzen und über Perspektiven für eine andere Art der Bekämpfung von Bakterien. Dieser Faktencheck stellt die folgenden Fragen:
- Was sind Antibiotika und wie funktionieren sie?
- Warum gibt es antibiotikaresistente Bakterien?
- Welchen Schaden richten Resistenzen an?
- Wie lassen sich Antobiotikaresistenzen bekämpfen?
- Ist es gelungen, den Antibiotikaverbrauch zu reduzieren?
- Sind die Resistenzen zurückgegangen?
- Kann man auf neue Antibiotika hoffen?
Dr. Jacques Zimmer vom Luxembourg Institute of Health (LIH) und Mitglieder der Arbeitsgruppe "Surveillance" des Plan National Antibiotiques der Gesundheitsbehörde haben uns bei der Ausarbeitung dieses Artikels beraten.
Zusammenfassung
Antibiotika sind ein Grundpfeiler der modernen Medizin, ihre Wirksamkeit ist jedoch immer weniger garantiert. Gründe dafür sind die Zunahme antibiotikaresistenter Bakterien und die Verbreitung multiresistenter Keime in der Umwelt und der Bevölkerung.
Die Entstehung resistenter Bakterien ist zwar ein natürlicher Vorgang, der sich nicht verhindern lässt, er wird aber durch einen häufigen und breiteren Gebrauch von Antibiotika beschleunigt. Ein breiterer Einsatz von Antibiotika ist vorteilhaft, wenn diese eingesetzt werden, um Infektionskrankheiten zu behandeln – die unbehandelt zum Teil tödlich verlaufen – und so die Gesundheit der Bevölkerung zu verbessern, insbesondere in Ländern mit niedrigem Einkommen. Aber ein Teil der Antibiotika wird ohne medizinischen Nutzen eingenommen. Das gilt insbesondere für ungerechtfertigte Verschreibungen, unsachgemäße Anwendung durch die Patienten oder den unangemessenen Einsatz in der Tierzucht. Dieser übermäßige Verbrauch begünstigt die Entwicklung von antibiotikaresistenten Bakterien. Es ist von unbedingter Wichtigkeit, diese Entwicklung zu verlangsamen, um zu verhindern, dass die Medikamente in einigen Jahren nicht mehr wirksam sind.
Seit Ende der 1990er-Jahre lässt sich eine starke Zunahme der Antibiotikaresistenzen beobachten. In der EU scheinen sie sich in den letzten 20 Jahren teilweise stabilisiert zu haben, und in Luxemburg gibt es – auf der Grundlage noch sehr begrenzter Daten – erste Anzeichen, die in den letzten Jahren in dieselbe Richtung weisen. Luxemburg hat den Antibiotikaverbrauch in den letzten zehn Jahren zurückgefahren, und zwar um ein Viertel in der Humanmedizin und um fast die Hälfte in der Tierhaltung. Aber der Anteil resistenter Bakterien ist nach wie vor sehr hoch, und die WHO meldet „alarmierende“ Werte auf internationaler Ebene.
Im Gesundheitswesen wird der Ruf nach neuen Wirkstoffen laut, die (noch) keine Resistenzen hervorrufen, aber die Entdeckung und Vermarktung neuartiger Produkte sind in den letzten 50 Jahren stark zurückgegangen. Das liegt unter anderem an mangelnden wirtschaftlichen Anreizen für Pharmaunternehmen, in diesen wenig rentablen Markt zu investieren. Neue Ansätze wie die Immuntherapie oder der Einsatz von Viren, die Bakterien zerstören, befinden sich in der Entwicklung. Auch Impfstoffe sind ein wichtiges Mittel, um bakteriellen Infektionen vorzubeugen.
Wir haben den Stand der Wissenschaft zu diesem Thema auch in einem kurzen „Ziel mir keng!“-Video zusammengefasst, das auf dem YouTube-Kanal von science.lu veröffentlicht wurde, nachdem es auf RTL Télé Lëtzebuerg am Sonntagabend, 24. November, 19 Uhr, im Rahmen der Sendung PISA - de Wëssensmagasin ausgestrahlt wurde.
Was sind Antibiotika und wie funktionieren sie?
Antibiotika sind Substanzen, die Bakterien abtöten oder ihr Wachstum hemmen. In der Humanmedizin werden sie eingesetzt, um bakterielle Infektionen zu behandeln, die eine Vielzahl von Krankheiten verursachen, wie Lungenentzündung, Nasennebenhöhlenentzündung, Mittelohrentzündung, Harnwegsinfektionen und Hirnhautentzündung, aber auch Krankheiten, die in unseren Breitengraden weniger häufig vorkommen, wie Syphilis, Tuberkulose, Lepra, Diphtherie, Typhus, Cholera und Tetanus. Die Wirkung von Antibiotika ist enorm: Seit der Einführung von Penicillin 1942 ist die Sterblichkeit aufgrund von Infektionskrankheiten in den USA und Großbritannien um 70 % gesunken.
Sie werden auch prophylaktisch eingesetzt, um Infektionen in Risikosituationen zu vermeiden, zum Beispiel bei Operationen (darunter Transplantationen, Kaiserschnitte und einige orthopädische Eingriffe), bei Menschen mit geschwächtem Immunsystem (etwa während einer Chemotherapie gegen Krebs) oder bei bestimmten chronischen Infektionen.
Trotz des Erfolges von Antibiotika stellen bakterielle Infektionen nach wie vor ein großes Gesundheitsrisiko dar. Schätzungen zufolge sind sie für etwa jeden siebten Todesfall weltweit verantwortlich, das entspricht 13,7 Millionen im Jahr 2019. Die Hälfte davon wird von nur fünf Bakterien verursacht: Staphylococcus aureus, Escherichia coli, Streptococcus pneumoniae, Klebsiella pneumoniae und Pseudomonas aeruginosa. Sie können insbesondere Infektionen der Atemwege (z. B. Lungenentzündung), des Blutes (Sepsis), des zentralen Nervensystems (z. B. Hirnhautentzündung) oder des Verdauungstraktes verursachen.
Antibiotika werden auch in der Tiermedizin zur Behandlung bakterieller Infektionen eingesetzt, zum Teil auch prophylaktisch (siehe unten).
Antibiotika können natürlichen Ursprungs (das heißt, sie werden von Bakterien, Pilzen oder Schwämmen gebildet) oder rein synthetisch sein oder durch Veränderung natürlicher Verbindungen hergestellt werden.
Antibiotika können kurzfristige Nebenwirkungen haben (Übelkeit, Durchfall, allergische Reaktionen), aber auch langfristige, wenn sie die Darmflora aus dem Gleichgewicht bringen und Erkrankungen des Verdauungstrakts begünstigen. Ein weiterer Nachteil ist, dass ihr Einsatz die Entstehung resistenter Bakterien fördert (siehe Rest des Artikels).
So funktionieren Antibiotika
Die WHO listet 258 Antibiotika. Das erste Antibiotikum war das Syphilis-Medikament Salvarsan, das 1911 auf den Markt kam. Das berühmte Penicillin wurde 1928 von Fleming entdeckt, aber erst 1942 zum ersten Mal für die Behandlung von Kranken eingesetzt.
Antibiotika wirken unterschiedlich. Einige töten die Bakterien ab, indem sie die Aufrechterhaltung ihrer äußeren Hülle verhindern (z. B. Polymyxine und Beta-Laktam-Antibiotika wie Penicilline und Cephalosporine) oder indem sie die Replikation der bakteriellen DNA blockieren (z. B. Chinolone). Andere verlangsamen oder hemmen das Wachstum der Bakterien, indem sie auf den bakteriellen Stoffwechsel einwirken (z. B. Sulfamide) oder die Proteinsynthese verhindern (z. B. Tetracycline und Makrolide).
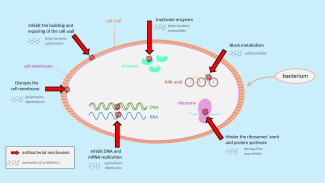
Abbildung 1. Die verschiedenen Antibiotikaklassen wirken auf unterschiedliche Weise auf die Bakterien ein. Einige greifen die Bakterienhülle an, andere stören den Stoffwechsel oder die Proteinsynthese.
Infobox
Desinfektionsmittel und Antiseptika – wie Alkohol, Wasserstoffperoxid, Chlorderivate (Bleichmittel) oder Jodderivate (Betadin) – sind weniger spezifisch als Antibiotika und wirken meist auch gegen andere Arten von Mikroben (Viren und Pilze). Desinfektionsmittel werden auf unbelebten Flächen (Tische, Instrumente usw.) angewandt, Antiseptika auf dem Körper (Haut, Schleimhäute oder Wunden). Antibiotika hingegen werden oral (Tabletten), per Injektion (intravenös oder in den Muskel) oder lokal (Creme oder Flüssigkeit für Haut, Augen, Ohren usw.) verabreicht. Desinfektionsmittel und Antiseptika werden also lokal auf einer begrenzten Fläche angewandt, während Antibiotika häufig systemisch gegeben werden, das heißt im ganzen Körper wirken.
Antiseptika und Desinfektionsmittel wirken beispielsweise durch die Zerstörung der Bakterienmembran (Alkohol, Jod) oder als Oxidationsmittel, die die Rolle der Proteine in den Mikroben stören (Bleichmittel, Wasserstoffperoxid).
Warum gibt es antibiotikaresistente Bakterien?
Bakterien entwickeln, wie andere Mikroben auch, auf natürliche Weise Resistenzen gegen Wirkstoffe, die gegen sie eingesetzt werden. Dies ist ein unvermeidbares Phänomen, das mit der natürlichen Selektion zusammenhängt und an das wir uns anpassen müssen. So verfügen einige Bakterienstämme – angeboren oder durch Mutation – über spezifische Eigenschaften, die sie gegen ein Antibiotikum schützen und es ihnen ermöglichen, in größerer Zahl zu überleben als andere Stämme. Ihre Population wächst schneller, wodurch sich der Gesamtanteil resistenter Bakterien in der Umwelt erhöht.
Die Resistenz wird auf natürliche Weise an die Nachkommen weitergegeben, kann sich aber auch durch Gentransfer ausbreiten, wenn ein Bakterium die DNA eines anderen Bakteriums aufnimmt. Die Resistenz kann sich dann schnell auf andere Bakterienstämme übertragen.
Einige Bakterien entwickelten bereits seit den 1970er/1980er-Jahren Resistenzen gegen verschiedene Antibiotika. Diese multiresistenten Bakterien haben sich diversifiziert und nach 1990 in der Umwelt verbreitet. Hochresistente Bakterien wurden in den 2000er-Jahren erstmals beobachtet und verbreiteten sich ab 2010.
Video oben: Dieses Experiment, das von Wissenschaftlern des Kishony-Labors der Harvard Medical School und des Technion (www.technion.ac.il/en/) gefilmt wurde, zeigt auf beeindruckende Weise, wie sich Bakterien bewegen, wenn sie mit immer höheren Dosen von Antibiotika konfrontiert werden und sich anpassen, um zu überleben und zu wachsen. Quelle.
Missbräuchlicher Einsatz von Antibiotika
Dass Resistenzen auftauchen lässt sich nicht vermeiden, aber dies hat sich durch den häufigeren Kontakt zwischen Bakterien und Antibiotika beschleunigt. Ein Grund dafür ist der allgemeine Anstieg des Einsatzes von Antibiotika in der Humanmedizin. Eine Studie schätzt, dass der Antibiotikaverbrauch pro Person weltweit zwischen 2000 und 2018, also in weniger als 20 Jahren, um 46 % gestiegen ist.
Ein zentrales Problem in diesem Zusammenhang ist der unsachgemäße Einsatz von Antibiotika. Sie werden häufig ohne gerechtfertigte Indikation verschrieben oder falsch angewendet, was die Entwicklung von Resistenzen beschleunigt, ohne einen klaren gesundheitlichen Nutzen zu bringen. Etwa 20 bis 30 % der Antibiotika werden vermutlich unnötigerweise verschrieben, beispielsweise, um eine Grippe oder eine Erkältung zu behandeln, die durch Viren und nicht durch Bakterien ausgelöst wurden. Darüber hinaus werden Antibiotika häufig falsch angewendet und Dosen und Behandlungsdauer nicht eingehalten. Dadurch verringert sich die Chance, dass die Behandlung die Bakterien, gegen die sie gerichtet ist, abtötet. Überlebende Bakterien entkommen und verbreiten Resistenzen.
Ein großes Problem ist darüber hinaus der massive Einsatz von Antibiotika in der Nutztierzucht. Sie werden in großem Umfang zur Vorbeugung eingesetzt, sowie als Wachstumsförderer, um die Gewichtszunahme der Tiere zu beschleunigen (eine Praxis, die in der EU seit 2006 verboten ist). Der Großteil (zwischen zwei Dritteln und drei Vierteln) der in den USA verkauften Antibiotika wird in der Tierzucht eingesetzt, der Rest in der Humanmedizin.
Der Einsatz von Antibiotika als Wachstumsförderer in der Tierernährung ist in der EU seit 2006 verboten. Die Einfuhr von tierischen Erzeugnissen oder Tieren, die Arzneifuttermittel erhalten haben, ist seit 2022 nicht mehr zulässig. Der Einsatz von Antibiotika zur Behandlung und Vorbeugung von Krankheiten ist jedoch erlaubt, sofern er kontrolliert und nicht systematisch erfolgt.
All diese Antibiotika kommen mit zahlreichen (schädlichen wie harmlosen) Bakterien in der Umwelt, in Tieren und in unserem Körper in Kontakt. Dies beschleunigt die Entwicklung resistenter Stämme und die Übertragung dieser Resistenzen.
Welchen Schaden richten Resistenzen an?
Der große Anteil an Bakterien mit Resistenzen gegen mindestens ein Antibiotikum führt zu signifikanten gesundheitlichen und wirtschaftlichen Problemen. Eine mit einem unwirksamen Antibiotikum behandelte Infektionskrankheit verschlimmert sich und birgt gesundheitliche Risiken: längere Krankheits- und Behandlungsdauer, längerer Krankenhausaufenthalt, Komplikationen. Sie kann tödlich enden, insbesondere, wenn es sich um eine Infektion mit Bakterien handelt, die gegen alle derzeit erhältlichen Antibiotika resistent sind.
Bei einem prophylaktischen Einsatz, beispielsweise bei einem chirurgischen Eingriff oder einer Chemotherapie, kann ein unwirksames Antibiotikum keine Infektionen mehr verhindern. Somit ist der Patient Komplikationen ausgesetzt, der Krankenhausaufenthalt verlängert sich vermutlich und die Gesundheit ist gefährdet. Je mehr Resistenzen es gibt, desto häufiger und gefährlicher werden nosokomiale Infektionen, die bei Krankenhausaufenthalten auftreten. Sie werden durch eine Anhäufung von infizierten Personen, das geschwächte Immunsystem der Patienten und die Pflege übertragen.
Antibiotikaresistente Bakterien waren 2020 für den Tod von etwa 35.000 Menschen in den EU/EWR-Ländern verantwortlich. Eine groß angelegte Studie schätzt, dass im Jahr 2019 weltweit 1,27 Millionen Menschen an antibiotikaresistenten Bakterien starben (doppelt so viele wie an Krankheiten wie Malaria oder AIDS). Rechnet man die Todesfälle ein, die mit resistenten Bakterien in Zusammenhang stehen, obwohl sie nicht direkt auf diese zurückzuführen sind, d. h. Fälle, in denen nicht klar ist, ob die Infektion die einzige Todesursache war, liegt die geschätzte Zahl viermal so hoch (bei 4,95 Millionen). Dasselbe Forschungsteam schätzte die Zahl der Todesfälle, die mit Bakterien im Allgemeinen in Zusammenhang stehen, unabhängig davon, ob es sich um resistente oder nicht resistente Bakterien handelte, auf 7,7 Millionen, was darauf hindeutet, dass resistente Stämme mit zwei Dritteln aller durch Bakterien verursachten Todesfälle in Verbindung gebracht werden.
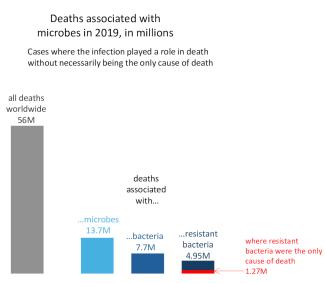
Abbildung 2: Eine Studie schätzt, dass resistente Bakterien im Jahr 2019 weltweit die alleinige Ursache für 1,27 Millionen Todesfälle waren. Fast fünf Millionen Todesfälle wurden mit resistenten Bakterien in Verbindung gebracht, ohne dass diese Infektionen unbedingt die einzige Todesursache waren – das sind zwei Drittel der 7,7 Millionen Todesfälle, die mit Infektionen durch resistente oder nicht resistente Bakterien in Verbindung gebracht wurden. Von den insgesamt 56 Millionen Todesfällen im Jahr 2019 wurden etwa sechs Millionen mit anderen mikrobiellen Infektionen (Viren, Pilze, Parasiten) in Verbindung gebracht. (Quelle)
Eine im September 2024 veröffentlichte Aktualisierung analysiert die Entwicklung der letzten 30 Jahre und kommt zu dem Schluss, dass sich die Trends je nach Alter und Ort sehr stark unterscheiden. Die von resistenten Bakterien verursachten Todesfälle sind bei Kindern unter fünf um die Hälfte zurückgegangen, während sie bei Erwachsenen im Alter von 70 oder älter um 80 % angestiegen sind. Die Prognosen für 2050 gehen von 1,9 Millionen von resistenten Bakterien verursachten Todesfällen (und 8,2 Millionen Todesfällen im Zusammenhang mit resistenten Bakterien) weltweit aus.
Wie lassen sich Antibiotikaresistenzen bekämpfen?
Antibiotika besser und in geringerem Umfang einsetzen und überwachen
Um resistente Bakterien zu bekämpfen, ist es von grundlegender Bedeutung, die Menge der in Medizin und Tierzucht eingesetzten Antibiotika zu reduzieren. Darüber hinaus ist es wichtig, die Behandlungen gezielt einzusetzen – beispielsweise indem sichergestellt wird, dass eine Infektion auch tatsächlich bakteriell und nicht viral ist, und ein Antibiotikum gewählt wird, das die verantwortlichen Bakterien auf Basis einer mikrobiologischen Diagnostik gezielt angreift. Außerdem sollten jene Moleküle, gegen die bisher noch kaum Bakterien resistent sind, so wenig wie möglich verschrieben werden: Ziel ist es, sie als „letztes Mittel“ in Reserve zu halten und nur dann auf Empfehlung von Infektiologen einzusetzen, wenn Standardantibiotika nicht mehr wirken.
Ein weiterer wichtiger Schwerpunkt ist die Überwachung des Antibiotikaverbrauchs, der multiresistenten Keime und der Resistenzentwicklung. Auch die Übertragungswege von Resistenzen müssen untersucht werden: zwischen Bakterien, vom Boden auf Pflanzen, vom Tier auf den Menschen, von Reiserückkehrern oder auch beim Tierarzt. Ziel ist es, die Ausbreitung von Resistenzen vorherzusehen und Interventionsmöglichkeiten zu ermitteln.
Unterschiedliche Organisationen wie die WHO rufen seit Jahrzehnten dazu auf, der Zunahme von Resistenzen etwas entgegenzusetzen. Sie befürworten den sogenannten One Health-Ansatz, der die Wechselwirkungen zwischen Mensch, Tier und Umwelt berücksichtigt. Seit den 2000er-Jahren haben zahlreiche Staaten – so auch Luxemburg – nationale Programme aufgelegt, um den Antibiotikaverbrauch zu senken und zu überwachen.
Ist es gelungen, den Antibiotikaverbrauch zu reduzieren?
In der Humanmedizin
In Luxemburg
Der Antibiotikaverbrauch in der Humanmedizin ist in Luxemburg zwischen 2012 und 2022 um ein Viertel zurückgegangen. Dieser Rückgang betrifft in Apotheken ausgegebene und in Krankenhäusern verabreichte Antibiotika. Letztere machen etwa 7 % der Gesamtzahl aus.
2022 war ein erneuter Anstieg in Luxemburg sowie in anderen europäischen Ländern zu beobachten. Er folgte auf den abrupten Rückgang während der Covid-19-Pandemie, der sich durch weniger häufige Infektionen aufgrund der umgesetzten Hygienemaßnahmen (Masken, Desinfektion, Lockdown) sowie weniger Arztbesuchen erklären lässt. Vergleiche sind jedoch auch deshalb schwierig, weil sich das Datenverarbeitungsverfahren in Luxemburg 2020 geändert hat.
Infobox
Die Menge der verbrauchten oder verschriebenen Antibiotika wird üblicherweise in definierten Tagesdosen (DDD) pro 1000 Einwohner und Tag ausgedrückt, wobei die DDD die empfohlene Dosis des Antibiotikums für eine Standardbehandlung ist. Der Penicillinverbrauch in Luxemburg von etwa acht DDD pro 1000 Einwohner und Tag im Jahr 2022 zeigt beispielsweise, dass durchschnittlich acht von 1000 Personen täglich die Standarddosis eingenommen haben. Dabei ist zu beachten, dass diese Dosen je nach Antibiotikum und Infektion variieren.
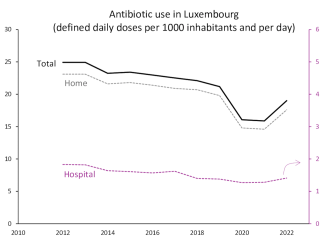
Abbildung 3: Antibiotikaverbrauch in Luxemburg in der stationären (rechte Achse) und in der ambulanten Versorgung (linke Achse), ausgedrückt in Tagesdosen pro 1000 Einwohner pro Tag. (Quelle)
Luxemburg hat 2018 einen nationalen Plan zur Bekämpfung von Resistenzen und ihrer Übertragung verabschiedet. Der "Plan National Antibiotiques" verfolgt den „One Health-Ansatz“, bei dem die menschliche Gesundheit unter Berücksichtigung von Fragen der Tiergesundheit und der Umwelt betrachtet wird. Dabei geht es insbesondere darum, den Antibiotikaverbrauch und die Verbreitung von Antibiotikaresistenzen bei Mensch und Tier zu überwachen und Rückstände in Lebensmitteln zu analysieren. Initiativen zur Reduzierung des Antibiotikaverbrauchs beim Menschen wurden in Luxemburg allerdings bereits vor mehr als 20 Jahren gestartet, z. B. durch Informationskampagnen für die breite Öffentlichkeit.
In Europa
Der Einsatz von Antibiotika unterscheidet sich in den Ländern der Europäischen Union stark. In Zypern oder Griechenland etwa ist der Verbrauch viermal so hoch wie in den Niederlanden. Die Länder mit dem niedrigsten Antibiotikaverbrauch liegen hauptsächlich in Nord- und Mitteleuropa, jene mit dem höchsten sind eher im Süden und Osten des Kontinents zu finden.
Luxemburg lag 2022 mit einem Wert von 19,1 definierten Tagesdosen pro 1000 Einwohner und Tag auf dem 16. Platz von 29 Ländern, knapp unter dem EU-Durchschnitt (19,4). In den meisten Ländern hat sich der Verbrauch stabilisiert oder ist gesunken, in einigen, wie Lettland, Portugal oder Irland, ist er aber auch gestiegen.
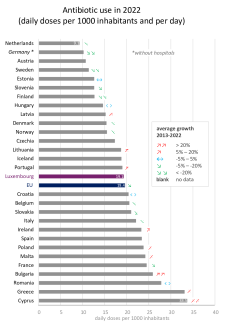
Abbildung 4: Antibiotikaverbrauch in der EU im Jahr 2022, in Tagesdosen pro 1000 Einwohner und Tag (ambulant und stationär). Die Pfeile zeigen einen starken (↘↘) oder mäßigen Rückgang (↘), keine signifikante Veränderung (↔) und einen mäßigen (↗) oder starken Anstieg (↗↗) an. Die Entwicklung ist nicht für alle Länder angegeben, insbesondere nicht für Luxemburg aufgrund einer Änderung der Methodik im Jahr 2020. (Quelle)
Weltweit
Der weltweite Pro-Kopf-Verbrauch von Antibiotika ist zwischen 2000 und 2018, also in weniger als 20 Jahren, um 46 % gestiegen. Dieser Anstieg ist vor allem in einkommensschwachen Regionen zu beobachten – eine erfreuliche Entwicklung, die auf einen verbesserten Zugang zu diesen wichtigen Arzneimitteln zurückzuführen ist.
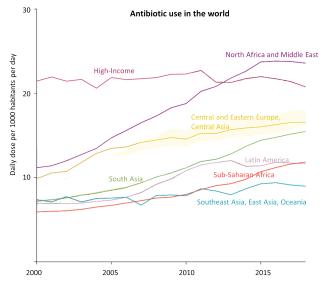
Abbildung 5: Der Antibiotikaverbrauch hat seit 2000 überall auf der Welt zugenommen, mit Ausnahme der einkommensstarken Länder, in denen er stabil geblieben ist. In der Region Nordafrika/Naher Osten und in Südasien hat er sich in 18 Jahren mehr als verdoppelt. (Quelle)
Reserveantibiotika
Um die Zunahme von Resistenzen zu verlangsamen, müssen Antibiotika sparsam eingesetzt werden, insbesondere jene, die noch sehr wirksam sind, weil sie erst vor Kurzem auf den Markt gebracht wurden. Die WHO hat Antibiotika 2017 in drei Gruppen eingeteilt:
- Die Kategorie „Access“ umfasst Moleküle, die als erste und zweite Wahl eingesetzt werden sollten und deren Verfügbarkeit stets gewährleistet sein muss. Sie wirken gezielt. Beispiele: Ampicillin, Doxycyclin, Metronidazol.
- Die Kategorie „Watch“ umfasst (gegen viele Arten von Bakterien wirksame) Breitbandantibiotika, die das Potential haben, resistente Bakterien zu behandeln. Sie sollten auf der Grundlage der Ergebnisse einer mikrobiologischen Diagnostik und nur dann eingesetzt werden, wenn die Medikamente der ersten Gruppe nicht geeignet sind. Beispiele: Ciprofloxacin, Fusidinsäure.
- Die Kategorie „Reserve“ bezieht sich auf als letztes Mittel eingesetzte Therapien, die nur in schweren Fällen und nur dann in Frage kommen, wenn andere Formen der Behandlung nicht wirksam sind, z. B. wenn eine Infektion durch Bakterien verursacht wird, die gegen mehrere Arten von Antibiotika resistent sind, so genannte multiresistente Bakterien. Beispiel: Daptomycin.
Die WHO empfahl 2023, dass mindestens 60 % der verordneten Antibiotika aus der Kategorie „Access“ stammen, um die anderen beiden Kategorien möglichst gut zu erhalten. In Luxemburg entfielen im Jahr 2022 60,8 % der ausgegebenen Mittel auf diese Kategorie, was der Empfehlung entspricht. Laut der Ziellegung vom Rat der EU soll dieser Wert im Jahr 2030 bei 65% liegen.
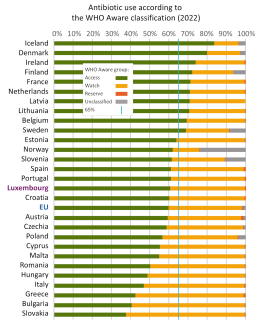
Abbildung 6: Anteil der in der EU verbrauchten Antibiotika der drei Kategorien nach WHO Aware. Die erste Kategorie, Access, sollte gemäß den Empfehlungen des Rates der EU bis 2030 mindestens 65 % betragen. (Quelle)
Weniger Antibiotika in der Tiermedizin in Luxemburg
Der Einsatz von Antibiotika bei Nutztieren ist in Luxemburg stark zurückgegangen und hat sich innerhalb von zehn Jahren fast halbiert (von 43 mg pro Kilogramm Tier im Jahr 2012 auf 25 mg pro Kilogramm im Jahr 2022). Der tatsächliche Rückgang dürfte etwas geringer ausfallen, da die Statistiken keine Antibiotika erfassen, die von Tierärzten im Grenzgebiet im Ausland gekauft und in Luxemburg verabreicht werden (diese Zahlen sollen in einem nächsten Bericht berücksichtigt werden). Hinzu kommen Antibiotika für Haustiere, die etwa 9 % der Gesamtmenge ausmachen.
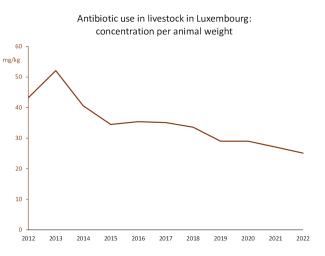
Abbildung 7: Luxemburg hat den Einsatz von Antibiotika in der Tierzucht für die Lebensmittelproduktion stark reduziert und die Konzentration pro Kilogramm Tier fast halbiert. (Quelle)
Luxemburg gehört zu den EU-Ländern mit dem geringsten Einsatz von Antibiotika in der Tierhaltung: Die Konzentration ist um ein Drittel niedriger als in Frankreich und fast dreimal niedriger als in Deutschland oder Belgien. Die Unterschiede sind extrem: Die Werte reichen von 2 mg/kg in Norwegen bis zum Hundertfachen in Zypern mit 254 mg/kg.
In der EU ist der Einsatz von Antibiotika in der Veterinärmedizin zwischen 2011 und 2023 im Durchschnitt um 53 % zurückgegangen. Auch auf globaler Ebene haben viele Länder ihren Antibiotikaeinsatz in der Landwirtschaft in ähnlichem Maße erfolgreich reduziert oder sind auf dem Weg dorthin. Die USA hinken etwas hinterher und haben ihren Einsatz medizinisch wichtiger Antibiotika zwischen 2012 und 2021 bei Nutztieren um 33 % reduziert.
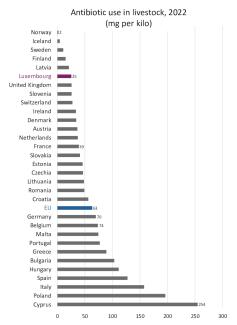
Abbildung 8: Luxemburg gehört zu den EU-Ländern mit dem geringsten Antibiotikaeinsatz in der Tierhaltung. (Quelle)
Sind die Resistenzen zurückgegangen?
Die Forderungen nach Reduzierung und Verbesserung des Antibiotikaeinsatzes wurden gehört und teilweise umgesetzt, was dazu beigetragen hat, die Zunahme von Resistenzen zu verlangsamen und in einigen Bereichen sogar zu stabilisieren.
In Luxemburg
Die verfügbaren Daten sind noch sehr begrenzt, so dass noch keine allgemeinen Schlussfolgerungen gezogen werden können, sondern nur von Hinweisen oder ersten Tendenzen die Rede sein kann.
In der Humanmedizin gibt es erste Hinweise darauf, dass die Resistenzen im Zusammenhang mit invasiven Infektionen (siehe Infobox) in Luxemburg zwischen 2018 und 2022 stabil geblieben oder zurückgegangen sind, allerdings mit einigen Ausnahmen. Die Analyse bezieht sich auf zehn Krankheitserreger, die im Rahmen von zwei europäischen Initiativen in allen EU-Ländern überwacht werden. Die Überwachung bewertet für jeden Erreger (E. coli, S. pneumoniae, E. faecalis usw.) den Anteil der Bakterien, die gegen verschiedene Antibiotikaklassen (Aminopenicilline, Cephalosporine, Carbapeneme usw.) oder deren Kombinationen resistent sind. Ein bekanntes Beispiel für ein solches multiresistentes Bakterium ist der Methicillin-resistente Staphylococcus aureus (MRSA).
Infobox
Die im ersten Überwachungsbericht zum Nationalen Antibiotikaplan vorgestellten nationalen Daten zu bakteriellen Resistenzen beziehen sich auf invasive Infektionen, die das Blut oder das Nervensystem betreffen. Sie werden jedes Jahr von den Krankenhäusern und privaten Laboren an das European Antibiotic Resistance Surveillance Network (EARS-net) übermittelt. Eine nationale Nachverfolgung von Resistenzen im Zusammenhang mit weniger schwerwiegenden Infektionen (Harnwegsinfektionen, Lungeninfektionen und andere) fehlt derzeit, wird aber in den Krankenhäusern durchgeführt. Allerdings überwacht FWD-Net, das Kontrollnetzwerk für enterische Pathogene (Salmonella, E. coli und Campylobacter), die durch Wasser und Lebensmittel übertragbare Krankheiten und Zoonosen verursachen, die Daten aller Labore für klinische Biologie in Luxemburg.
Es gibt also etwa 40 Krankheitserreger-Antibiotikum-Paare. Die meisten zeigen stabile oder abnehmende Resistenzen. Beispielsweise waren 2018 55 % der E.-coli-Bakterienstämme gegen Ampicilline resistent. Dieser Anteil ist bis 2022 auf 50 % gesunken, bleibt aber auf einem sehr hohen Niveau. Einige Paare zeigen eine Zunahme der Resistenzen, wie Salmonellen gegen Fluorochinolone oder S. pneumoniae gegen Makrolide.
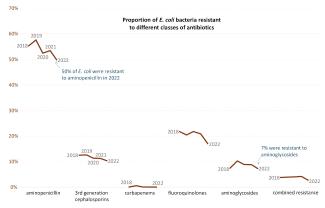
Abbildung 9: Entwicklung der Resistenzen von E.-coli-Bakterien gegen fünf Antibiotika und ihre Kombination. Entsprechende Grafiken gibt es auch für die anderen vom europäischen Netzwerk EARS-Net beobachteten Krankheitserreger. (Quelle)
In Europa
Die Situation in Europa ist noch uneinheitlicher, so dass zu den Unterschieden zwischen den Bakterium-Antibiotikum-Paaren noch die Unterschiede zwischen den Ländern hinzukommen. Eine Studie, in der die Entwicklung zahlreicher Erreger-Antibiotikum-Paare in den europäischen Ländern zwischen 1998 und 2019 analysiert wurde, zeigt, dass die Zunahme der Resistenzen nicht überall gleich ist. Von 887 untersuchten Bakterium-Antibiotikum-Land-Trios wiesen nur 17 % eine zunehmende Resistenz auf, die Hälfte war stabil oder dabei, sich zu stabilisieren.
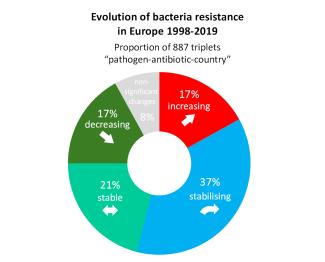
Abbildung 10: Die meisten der in den europäischen Ländern erfassten Erreger-Antibiotikum-Paare weisen eine stabile oder sich stabilisierende Resistenz auf. Bei einem Sechstel nimmt die Resistenz ab, bei einem weiteren Sechstel nimmt sie zu. (Quelle)
Weltweit
Die Zunahme von Antibiotikaresistenzen ist ein globales Phänomen, da Mikroben nicht vor Ländergrenzen haltmachen und sich resistente Stämme verbreiten. Die WHO berichtet von „alarmierenden“ Resistenzniveaus weltweit. Im Mittel von 76 Ländern sind 42 % der E.-coli-Stämme resistent gegen Cephalosporine der dritten Generation, 35 % der Staphylococcus-aureus-Stämme resistent gegen Methicilline und 20 % der Harnwegsinfektionen verursachenden E.-coli-Stämme resistent gegen Standardantibiotika. Die WHO stellt die Fortschritte bei der weltweiten Überwachung der Resistenzen fest, weist aber darauf hin, dass die nach wie vor bestehenden großen Unterschiede eine Analyse der Situation erschweren.
Kann man auf neue Antibiotika hoffen?
Wenig neue Wirkstoffe
Die Entdeckung neuer Antibiotikaarten hat sich stark verlangsamt: Die letzte große Antibiotikaklasse wurde 1987 entdeckt (und erst 2003 auf den Markt gebracht), gegenüber 26 seit den 1920er-Jahren, so die React-Initiative (Anmerkung: Die Zahl der Antibiotikaklassen variiert je nach Klassifikation). Ein anderer Artikel spricht von acht neuen Antibiotikaklassen, die seit den 1980er-Jahren auf den Markt gebracht wurden, gegenüber 30 zuvor.

Abbildung 11: Die großen Antibiotikaklassen wurden vor den 1980er-Jahren entdeckt. Seither sind neue Präparate selten geworden. Manche Moleküle brauchten mehrere Jahrzehnte, bis sie zugelassen wurden und auf den Markt kamen. Es wurden Resistenzen gegen alle diese Antibiotikaklassen beobachtet, manchmal sogar bevor sie auf den Markt kamen. (Quelle)
Für diese Verlangsamung gibt es mehrere Gründe. Erstens wurden die am leichtesten zu findenden Moleküle bereits identifiziert, insbesondere während der Blütezeit der Antibiotika zwischen 1940 und 1960. Zweitens bietet der Markt den Pharmaunternehmen wenig Anreize, in die Erforschung neuer Wirkstoffe zu investieren.
Eine Studie schätzt, dass die Entwicklung eines neuen Antibiotikums durchschnittlich 1,5 Milliarden Dollar kostet und zwölf Jahre dauert. Im Gegensatz zu anderen Medikamenten, wie z. B. Krebsmedikamenten, bringen Antibiotika aufgrund ihrer zeitlich begrenzten Anwendung keine hohen Einnahmen. Darüber hinaus dürfen neue Wirkstoffe oft nur sehr begrenzt eingesetzt werden, um die Entwicklung von Resistenzen zu vermeiden, und werden als letztes Mittel verschrieben, was ihren Absatz stark einschränkt. Ein Beispiel, das Aufmerksamkeit erregte, war die Firma Achaogen, die 15 Jahre lang ein neues Antibiotikum entwickelte und es 2018 auf den Markt brachte, aber ein Jahr später Konkurs anmeldete, da sie lediglich einen Umsatz von einer Million Dollar erzielt hatte.
Neue Therapien
Es kommen zwar neue Antibiotika auf den Markt, aber sie lösen das Problem der Resistenzen kaum. Von den 23 Molekülen oder Kombinationen von Molekülen, die zwischen 2013 und 2022 weltweit zugelassen wurden, verfügt keines über einen neuen Wirkmechanismus – das letzte Medikament mit einer neuen Wirkweise stammt aus dem Jahr 2012. Zwölf neue Therapien wurden zwischen 2017 und 2020 von den Behörden in den USA (FDA) oder der EU (EMA) zugelassen, aber sie bieten nur geringe Vorteile gegenüber bestehenden Medikamenten und gehören zu 80 % zu Antibiotikaklassen, gegen die laut WHO bereits Resistenzen bestehen.
Der WHO zufolge befanden sich 2021 etwa 217 neue Therapien in der präklinischen Entwicklung (Tests an Kulturen und Tieren) und 77 in der klinischen Phase. Einige verfolgen innovative Ansätze, insbesondere gegen Krankheitserreger, die multiple Resistenzen entwickelt haben, aber die WHO ist der Ansicht, dass die Antibiotika, die sich in der klinischen Phase befinden oder kürzlich zugelassen wurden, „nicht ausreichen, um die Herausforderung der zunehmenden Entstehung und Verbreitung von Resistenzen zu bewältigen“.
Die Veröffentlichung von Forschungsergebnissen über die Einführung einer neuen Klasse von Antibiotika im Jahr 2024 durch das Schweizer Unternehmen Roche hat Hoffnungen geweckt, die jedoch durch Befürchtungen dahingehend gedämpft wurden, dass das derzeitige Geschäftsmodell die Vermarktung neuer Antibiotika kaum fördert.
Wissenschaftler entwickeln andere Ansätze zur Bekämpfung von Bakterien wie Impfstoffe, Immuntherapie oder den Einsatz von bestimmten Viren, so genannter "Phagen", die Bakterien zerstören. Diese neuen Methoden, die noch in der Entwicklungsphase sind, würden viel gezielter wirken als herkömmliche Antibiotika, erfordern aber eine genaue Identifizierung der für die Infektion verantwortlichen Bakterien. Bevor sie zur Behandlung der häufigsten Infektionskrankheiten eingesetzt werden können, müssen aber überzeugende Ergebnisse erzielt werden.
Infobox
Am Luxembourg Institute of Health (LIH) arbeiten Jacques Zimmer und Carole Devaux an neuen Strategien zur Bekämpfung resistenter Bakterien. Sie entwickeln neue Präparate, die das Immunsystem aktivieren und sich damit von den traditionellen Antibiotika unterscheiden, welche die Krankheitserreger direkt angreifen. Diese Verbindungen enthalten Antikörperfragmente, die auf die natürlichen Killerzellen unseres Immunsystems abzielen und diese gegen die Bakterien aktivieren. Ein ähnlicher Ansatz wird in der Onkologie zur Behandlung bestimmter Krebsarten angewandt.
Autor: Daniel Saraga (Saraga Communications)
Illustrationen: Daniel Saraga
Redaktion: Michèle Weber (FNR)
Beratung: Jacques Zimmer (LIH) und Arbeitsgruppe Nationaler Antibiotikaplan (Gesundheitsbehörde)
Übersetzung: Nadia Taouil (t9n.lu)
Infobox
HERA factsheet - HEALTH UNION: Identifying top 3 priority health threats
It's time to fix the antibiotic market
Antimicrobial resistance: A frightening and complex public health challenge
Antiseptics and Disinfectants: Activity, Action, and Resistance
Global antibiotic consumption and usage in humans, 2000-18: a spatial modelling study
Research reveals levels of inappropriate prescriptions in England
Unnecessary Antibiotic Prescribing in US Ambulatory Care Settings, 2010–2015
Antibiotics shape microbiota and weight gain across the animal kingdom
Global Trends in Antimicrobial Use in Food Animals from 2017 to 2030
HealthforAnimals, 2024. How Prevention Can Reduce the Need for Antibiotics. Brussels
WOAH. 2023. Annual Report on Antimicrobial Agents Intended for Use in Animals, 7h Report
Surveillance of antimicrobial resistance in Europe, 2022 data
Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis
WHO: Fact Sheet, Malaria [Consulted July 2024]
WHO: Number of people dying of HIV-related causes, 2023 [Consulted July 2024]
Plan National Antibiotiques (2018-2022)
Global antibiotic consumption and usage in humans, 2000–18: a spatial modelling study
Antimicrobial consumption in the EU/EEA (ESAC-Net), Annual Epidemiological Report 2022
Antibiotiques: pour qu’ils restent efficaces, n’en abusons pas!
Temporal Trends in Antibiotic Resistance in Europe, 1998-2019
Global geographic trends in antimicrobial resistance: the role of international travel
Antimicrobial resistance, WHO [Consulted August 2024]
Global antimicrobial resistance and use surveillance system (GLASS) report 2022, WHO
Few antibiotics under development
Antibiotics: past, present and future
Antibiotics in the clinical pipeline as of December 2022
2021 Antibacterial agents in clinical and preclinical development: an overview and analysis, WHO
A new class of antibiotics is cause for cautious celebration — but the economics must be fixed