© shotshop
Bei der Behandlung bestimmter Krebsarten kommen unter anderem auch sogenannte Immun-Checkpoint-Inhibitoren (ICI) zum Einsatz. Bei den ICI handelt es sich um immuntherapeutische Medikamente, die in der Lage sind, die natürlichen Bremsmechanismen des Immunsystems zu beseitigen, um so einen Immunangriff auf die Krebszellen auszulösen.
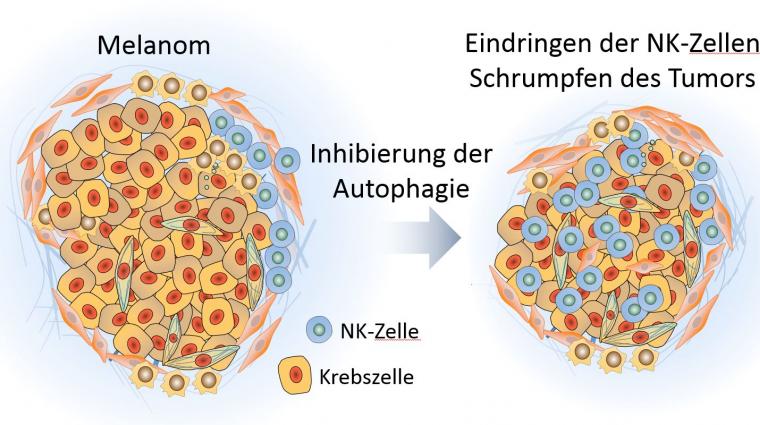
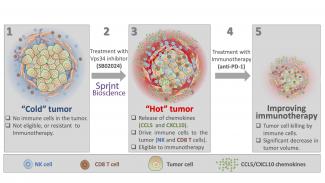
Immunzellen in schlecht infiltrierbare Tumore einschleusen
Diese Medikamente sind für die Behandlung einiger Krebsarten sehr vielversprechend. Allerdings stellt sich bei nur relativ wenigen Krebspatienten ein signifikanter therapeutischer Nutzen ein, wenn sie allein mit ICI behandelt werden. Aus diesem Grund besteht ein starker klinischer Bedarf darin, kombinatorische Therapien zu entwickeln, die die Ansprechraten erhöhen und die Anwendung der ICI auf eine größere Anzahl von Patienten und Tumorarten ausdehnen.
Eine der Hauptursachen für das mangelnde Ansprechen von Tumoren auf ICI ist die unzureichende Einwanderung zytotoxischer, also zelltötender Immunzellen in das Tumorbett dieser typischerweise immunresistenten Tumore. Die Wissenschaftler sprechen hier von „kalten“ Tumoren. „Heiße“, also entzündete Tumore hingegen werden von Immunzellen angegriffen und reagieren dementsprechend auch auf Immuntherapie. Entscheidend sind also Ansätze, die dabei helfen, Immunzellen in die schlecht infiltrierbaren „kalten“ Tumore einzuschleusen.
Zelltötende Immunzellen wandern in das Tumorbett
In diesem Zusammenhang haben Wissenschaftler des Luxembourg Institute of Health (LIH) unter der Leitung von Dr. Bassam Janji zusammen mit einem schwedischen Pharmaunternehmen eine innovative Strategie entwickelt, durch die zytotoxische Immunzellen besser in das Tumorbett einwandern können. Die Wissenschaftler haben dafür die Autophagie gehemmt: eine Art "Selbstverdauung", die in Zellen unter Stressbedingungen einsetzt, um das Überleben zu garantieren. Im Fall von Krebs kann dieser Prozess allerdings negative Folgen haben: In Krebszellen ist Autophagie manchmal hochgefahren, und es erlaubt den Krebszellen, Nährstoffe aufzunehmen und ihr Wachstum aufrechtzuerhalten.
Konkret griffen die Wissenschaftler auf mehrere Moleküle und Techniken zurück, um Autophagie zu hemmen. Darunter auch die Leitsubstanz namens SB02024 des schwedischen Pharmaunternehmens Sprint Bioscience, die gegen ein Schlüsselprotein namens Vps34 wirkt. Vps34 ist an der Initiierung des Autophagie-Prozesses beteiligt.
Hemmung der Autophagie führt zu einer erhöhten Freisetzung von Botenstoffen
Die Forscher verwendeten dafür präklinische Mausmodelle, um bei gezielten genetischen und pharmakologischen Manipulationen von Vps34 die Auswirkungen auf das Tumorwachstum und das Überleben von Mäusen zu untersuchen. Dabei fanden sie heraus, dass die Hemmung der Autophagie zu einer erhöhten Freisetzung von zwei bestimmten entzündungsfördernden Botenstoffen führt. Diese Botenstoffe, sogenannte Chemokine (CCL5 und CXCL10), werden bei der Reaktion des Immunsystems gebildet, um bestimmte Immunzellen an einen bestimmten Ort zu locken. Im Fall eines Tumors locken die Botenstoffe zelltödende Immunzellen, natürliche Killerzellen, Makrophagen (Fresszellen der weißen Blutkörperchen) und T-Zellen (weiße Blutkörperchen, die der Immunabwehr dienen) in die direkte Umgebung des Tumors.
Wirksamkeit immuntherapeutischer Medikamente signifikant verbessert
Diese Infiltration an Immunzellen führte sowohl bei Mäusen mit Melanomen als auch mit Darmtumoren zu einem verminderten Tumorwachstum und einem verlängerten Überleben. Diese Ergebnisse zeichneten somit die Vps34-Inhibitoren als wertvollen Wirkstoff aus, der Tumore für eine Immuntherapie auf der Basis von ICI zulässig und empfänglich macht. Darüber hinaus zeigte das Team von Dr. Janji, dass die Kombination aus dem Vps34-Inhibitor und dem sogenannten PD-1- Hemmer (ein anderer ICI) die Wirksamkeit dieses ICI bei resistentem Melanom und Darmkrebs signifikant verbessert.
Auf der Grundlage ihrer präklinischen Ergebnisse stellten die Wissenschaftler auch eine Vps34-Signatur fest. Anhand dieser Signatur konnten sie 470 Melanompatienten in drei Gruppen einteilen, die ein hohes, mittleres und niedriges Expressionsniveau der “Vps34- Signatur ” aufwiesen. Diese drei Gruppen entsprechen Patienten mit „heißen“, „mittleren“ und „kalten” Tumoren. Das Team zeigte, dass Patienten, die eine hohe Vps34-Signatur aufweisen, im Vergleich zu Patienten mit einer niedrigen Vps34-Ansprache signifikant länger überleben und krankheitsfrei sind.
Kombinatorischer Ansatz erweitert den therapeutischen Nutzen von ICIs
„Unsere Ergebnisse haben das Potenzial aufgezeigt, das die Inhibition des autophagiebezogenen Proteins Vps34 aufweist. Als innovativer kombinatorischer Ansatz erweitert es den therapeutischen Nutzen von PD-1-Hemmern auf Melanom- und Darmkrebspatienten, die auf diese bahnbrechende Immuntherapie sonst nicht ansprechen oder für sie nicht in Frage kommen würden“ , so Dr. Janji abschließend. „Darüber hinaus liefern unsere Ergebnisse den ersten Machbarkeitsbeweis für die Entwicklung innovativer klinischer Studien mit Vps34-Inhibitoren in Kombination mit PD-1-Hemmern."
Autor: LIH, Uwe Hentschel
Grafik: LIH
Infobox
Die von Dr. Bassam Janji und Dr. Guy Berchem gemeinsam verfasste Studie wurde in der renommierten Zeitschrift Science Advances unter dem vollständigen Titel “Inhibition of Vps34 reprograms cold into hot inflamed tumors and improves anti–PD-1/PD-L1 immunotherapy” veröffentlicht. Sie wurde in Zusammenarbeit mit Sprint Bioscience (Schweden), dem Centre Hospitalier de Luxembourg (CHL), dem Karolinska-Institut (Schweden) und der Universität von Pennsylvania (USA) durchgeführt. Finanziert wurde die durch Zuschüsse des FNR, des FNRS Televie, der Fondation Cancer, der Fondatioun Kriibskrank Kanner, der Janssen Cilag Pharma, der Action LIONS Vaincre le Cancer Luxembourg und der Schwedischen Stiftung für strategische Forschung.