(C) Communication LIH
Les chercheurs du LIH découvrent pour la première fois un mécanisme immunitaire prometteur pour de nouvelles stratégies thérapeutiques.


Des scientifiques Luxembourgeois du LIH ont découvert un mécanisme moléculaire, jusqu’à présent inconnu, qui favorise l'activation du système immunitaire humain. Leur projet de recherche a révélé que le glutathion, molécule produite entre autres par les cellules T (globules blancs) stimule le métabolisme énergétique de ces dernières. Cette découverte offre des points de départ et des perspectives pour développer de nouvelles stratégies thérapeutiques pour cibler le cancer et les maladies auto-immunes.
A quoi sert le glutathion ?
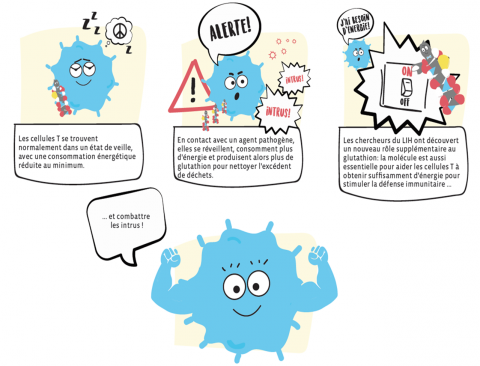
Pour faire simple, le glutathion est une molécule essentielle pour aider les cellules T à obtenir suffisamment d'énergie pour se développer, se diviser et combattre les intrus lorsqu'ils sont en contact avec des agents pathogènes tels que des virus par exemple. Elle joue donc un rôle clé pour une réponse immunitaire optimale.
Quel lien avec le cancer et les maladies auto-immunes (MAI) ?
"Notre corps doit maintenir notre système immunitaire dans une situation d’équilibre délicate", explique le Prof. Dirk Brenner. "Si nos défenses internes sont hyperactives, elles se retournent contre le corps. C'est ce qui se passe dans les maladies auto-immunes comme la sclérose en plaques ou l'arthrite, par exemple. Cependant, si elles sont trop faibles, les infections ne peuvent pas être contrées ou les cellules du corps peuvent proliférer sans contrôle et se développer pour former des tumeurs, ce qui peut devenir mortel."
Les cellules immunitaires telles que les cellules T se trouvent normalement dans un état d'hibernation, leur consommation d'énergie réduite au minimum. Si des agents pathogènes entrent en contact avec ces dernières, elles se réveillent et stimulent leur métabolisme pour produire plus d'énergie. Cela induit une plus grande quantité de déchets métaboliques qui peuvent être toxiques pour les cellules comme p.ex. les dérivés réactifs d'oxygène (ROS) et les radicaux libres. Lorsque la concentration de ces oxydants augmente, les cellules T doivent produire plus d'antioxydants afin de ne pas être empoisonnées.
En explorant le mécanisme d’action des antioxydants dans les lymphocytes T, l'équipe du Prof. Brenner a découvert pour la première fois que le glutathion sert non seulement d’éboueur en éliminant les déchets métaboliques, mais joue aussi un rôle essentiel dans l’activation du métabolisme énergétique qui contrôle la réponse immunitaire, et est donc de toute première importance pour diverses maladies. «Ces résultats fascinants forment une base pour une intervention ciblée dans le métabolisme des cellules immunitaires et pour le développement d’une nouvelle génération d'immunothérapies», explique le Prof. Markus Ollert.
De l’observation aux résultats
Dans le cadre de leurs recherches, les scientifiques ont utilisé des modèles animaux ayant des cellules T incapables de produire du glutathion. "Chez ces souris, nous avons découvert que la réponse immunitaire induite par une attaque virale est altérée - ces souris ont une immunodéficience. Mais cela signifie également que ces souris ne pouvaient pas développer de maladie auto-immune telle que la sclérose en plaques ".
D'autres tests effectués par l'équipe du Prof. Brenner en ont montré la raison:" Les souris ne peuvent pas produire de glutathion dans leurs cellules T ", Brenner continue, "En conséquence, sans glutathion, les cellules T ne deviennent pas entièrement fonctionnelles; Elles restent dans leur état d'hibernation et aucune réponse auto-immune ne se produit ". Le Pr. Karsten Hiller, qui a collaboré sur le projet ajoute: “Il est étonnant de voir que le métabolisme cellulaire et la réaction immunitaire sont si étroitement liés et qu’une interaction très précise est nécessaire pour permettre un fonctionnement correct.
Quelles potentielles applications pour les MAI et le cancer ?
Le Prof. Dirk Brenner voit ses expériences sur les cellules T comme un prélude à une étude plus approfondie du bilan énergétique des cellules immunitaires en général. Un certain nombre de maladies auto-immunes, par exemple, sont liées à des dysfonctionnements dans divers sous-groupes de cellules T. "Si nous comprenons les différences dans les mécanismes moléculaires par lesquels elles stimulent leur métabolisme pour obtenir de l'énergie lors de réponses immunitaires défensives ou de réactions auto-immunes, nous pouvons découvrir des indices sur les points d'attaque possibles pour les traitements régulant la réponse immunitaire".
Le chercheur voit une application semblable dans le cas du cancer: "Dans ce contexte également, il est important de savoir pourquoi les cellules immunitaires qui sont censées lutter contre les cellules cancéreuses restent en hibernation et, dans certains cas, suppriment activement une réponse immunitaire contre la tumeur. Des mesures de stimulation du métabolisme pourraient permettre aux cellules immunitaires de fonctionner de manière plus optimale et de lutter plus efficacement contre le cancer ".
Les scientifiques ont publié leurs résultats dans le journal d'immunologie le plus prestigieux du monde, «Immunity» (DOI: 10.1016/j.immuni.2017.03.019.)
Auteur : LIH
Editeur : Constance Lausecker
Photo : © Communication LIH
Infobox
Les chercheurs prévoient d’étendre leurs recherches pour identifier des molécules cibles permettant des interventions thérapeutiques. Les groupes de Luxembourg et Braunschweig soumettent actuellement une demande de financement pour un projet commun auprès de la Fondation allemande pour la recherche (DFG) et du Fonds National de la Recherche Luxembourg (FNR).
Le Professeur Dirk Brenner est Responsable Adjoint Recherche et Stratégie du « Department of Infection and Immunity » du LIH. Il a reçu une subvention ATTRACT Consolidator du Fonds National de la Recherche Luxembourg en 2015, pour mettre en place le « Experimental & Molecular Immunology research group ». Le programme ATTRACT soutient les instituts de recherche nationaux en leur permettant d’étendre leurs compétences dans des domaines de recherche stratégiques – en attirant des jeunes chercheurs d’excellence à haut potentiel au Luxembourg. L'étude a été réalisée en étroite collaboration avec le Professeur Karsten Hiller, du Metabolomics Group du « Luxembourg Centre for Systems Biomedicine » de l’Université du Luxembourg » (qui travaille actuellement au Centre intégré de biologie des systèmes (BRICS) de la Technische Universität Braunschweig en Allemagne) et avec Prof. Tak W. Mak. Directeur du Campbell Family Institute for Breast Cancer Research à l'Université de Toronto, au Canada.