shotshop.com
Ein Impfstoff könnte vieles ändern. Doch wo stehen wir? Ein Überblick.
Gibt es bereits einen zugelassenen Impfstoff gegen das SARS-CoV-2 Virus?
Ja, den gibt es tatsächlich. Am 11. August 2020 wurde der vom Moskauer Gamaleja-Institut für Epidemiologie und Mikrobiologie entwickelte Impfstoff „Sputnik V“ von den russischen Behörden zugelassen. Gam-COVID-Vac Lyo, so die wissenschaftlich Bezeichnung, ist ein Vektorimpfstoff. Als solcher nutzt er harmlose Viren als Transportvehikel, um Teile des SARS-CoV-2 Virus in den Organismus zu transportieren und dort eine Immunreaktion auszulösen.
Dieses Vorgehen stieß weltweit auf Vorbehalte und Kritik, da der Zulassung keine Phase 3 Studie vorangegangen war. Ebenfalls ohne abgeschlossene Phase 3 Studie gab der russische Präsident Wladimir Putin am 14. Oktober 2020 die Zulassung eines zweiten Impfstoffes mit der Bezeichnung EpiVacCorona bekannt und stellte ein drittes Präparat in Aussicht.
Mehr zu den russischen Impfstoffen und der internationalen Kritik an deren Zulassung weiter unten.
Infobox
Die beiden in Russland zugelassenen Impfstoffe haben die Phase 3 Studie übersprungen. Impfstoffe müssen nicht nur zuverlässig vor einer Erkrankung schützen, sondern auch möglichst sicher – also frei von schweren Nebenwirkungen – sein. Deshalb ist es internationaler Standard, dass vielversprechende Impfstoffkandidaten einer klinischen Prüfung unterzogen werden müssen, bevor sie zugelassen werden. Diese ist dreigeteilt. In Phase 1 wird an wenigen gesunden Probanden getestet, ob der Wirkstoff verträglich ist und ob er eine Immunantwort hervorrufen kann. In der anschließenden Phase 2 wird an einigen hundert Freiwilligen nach der optimalen Dosis gesucht. Außerdem werden wieder Immunantwort und Verträglichkeit bewertet. Erst in Phase 3 werden die Untersuchungen auf mehrere tausend Menschen ausgeweitet. Dabei werden oft auch junge und alte Menschen einbezogen, die in den vorangegangenen Studienphasen selten vertreten sind.
Der Zulassung von „Sputnik V“ war hingegen lediglich Phase 2 Studien vorausgegangen. Erste Daten dieser Versuche publizierten die Wissenschaftler Anfang September in der Fachzeitschrift The Lancet. Demnach soll der Impfstoff bei allen Studienteilnehmern zur Bildung von Antikörpern gegen das Virus geführt haben. Schwerwiegende Nebenwirkungen seien hingegen nicht beobachtet worden. Anders als international üblich hat die Phase 3 Studie erst knapp einen Monat nach Zulassung des Impfstoffes begonnen. Anfang September 2020 wurden in Moskau die ersten Testpersonen geimpft. Anfang Oktober hat auch Venezuela damit begonnen, „Sputnik V“ in einer klinischen Studie zu testen. Aktuelle Zwischenergebnisse (Stand: 11.11.2020) daraus weisen laut dem russischen Staatsfonds RDIF darauf hin, dass der Impfstoff in 92 Prozent der Fälle vor einer Infektion schützen soll.
Aus Sicht der Kritiker seien zwei Phase 2-Studien mit jeweils 38 Teilnehmern zu wenig, um Rückschlüsse über mögliche Nebenwirkungen zu ziehen – vor allem, wenn diese selten auftreten. Außerdem wird auf fehlende Erfahrungen mit älteren Menschen hingewiesen. Weitere Kritik kommt von knapp 40 Wissenschaftlern, die mit einem offenen Brief auf die Veröffentlichung aus Russland reagierten. Die Unterzeichner weisen auf mehrere auffällige Datenmuster hin. Besonders die über mehrere Probanden identischen Werte für die gebildeten Antikörper sind nach ihrer Meinung sehr unwahrscheinlich. Deshalb fordern sie die Bereitstellung der Originaldaten aus den beiden Studien.
Wie viele SARS-CoV-2 Impfstoffe werden zurzeit erforscht?
Aktuell (Stand: 12. November 2020) zählt die Weltgesundheitsorganisation WHO 212 laufende Impfstoffprojekte. Davon befinden sich 164 in der präklinischen Phase und 48 Impfstoffkandidaten in der klinischen Erprobung. Aktuellere Zahlen hält hingegen der Verband Forschender Arzneimittelhersteller bereit. Er zählt insgesamt mindestens 224 Projekte (Stand: 16. November 2020). Von diesen befinden sich 10 Präparate in der entscheidenden Phase 3 der klinischen Erprobung. Bei einem kleinen Teil dieser Impfstoffe haben die Entwickler bereits einen Teil des Zulassungsantrages vorgezogen. Rolling Submission nennt sich diese Praxis, bei der die vorliegenden Ergebnisse durch die zuständige Arzneimittelbehörde bereits begutachtet wird, während die Studien noch in vollem Gange sind. In den USA ist das die Regel bei der Arzneimittelzulassung. Bei der Europäische Arzneimittel-Agentur (EMA) werden aktuell drei SARS-CoV-2 Projekte vorab geprüft – das sind die Impfstoffe von Biontech/Pfizer, AstraZeneca und Moderna.
Wie funktionieren die verschiedenen Phasen der Impfstoffentwicklung?
Hierzu haben wir einen Artikel veröffentlicht. Den findest Du hier:
Wann könnte der erste Impfstoff in Europa zugelassen werden?
Am weitesten fortgeschritten scheinen aus aktueller Sicht der Impfstoff BNT162b2, den das deutsche Pharmaunternehmen Biontec und der US-amerikanische Konzern Pfizer gemeinsam entwickelt haben, sowie der Impfstoff mRNA-1273 vom amerikanischen Hersteller Moderna.
In den USA wollen die Unternehmen eine Notfallzulassung beantragen. In den USA ist es üblich, dass die Behörden bereits die laufenden Ergebnisse einer Studie begutachten. In Europa werden die gesammelten Unterlagen normalerweise erst nach Studienabschluss bei der zuständige Arzneimittelbehörde EMA eingereicht. Für den Biontech/Pfizer Impfstoff haben die Hersteller allerdings ein Rolling Review beantragt. Bei dieser vorgezogenen Prüfung begutachtet die Behörde die bereits vorliegenden Daten ebenfalls. Trotz der Beschleunigung wird geschätzt, dass der Impfstoff „frühestens Anfang kommenden Jahres“ in Europa zugelassen wird. Die luxemburgische Gesundheitsministerin Paulette Lenert geht davon aus, dass der Impfstoff im ersten Quartal 2021 zugelassen und dann auch in Luxemburg verfügbar sein soll. Die Mitgliedsstaaten beschaffen den Impfstoff aber nicht selbst. Denn das übernimmt die EU-Kommission. Die hat bereits Lieferverträge mit vier verschiedenen Impfstoffherstellern geschlossen – darunter auch mit Biontech/Pfizer.
Wie sehen die Zwischenergebnisse dieser zwei Impfstoffkandidaten aus?
BionTech/Pfizer: Die beiden Unternehmen haben am 8. November 2020 erste vielversprechende Ergebnisse einer Zwischenauswertung der Phase 3 Studie in einer Pressemitteilung veröffentlicht. In der noch laufenden Placebo-kontrollierten, randomisierten Doppelblindstudie wurde das Serum bis zu dem Zeitpunkt an insgesamt 43.538 Personen getestet, von denen bereits 38.955 zwei Impfstoffdosen bekommen haben. Placebo-kontrolliert heißt, ein Teil der Probanden den Impfstoff und ein anderer Teil ein Placebo erhält (in Fall dieses Impfstoffs eine 0.9%ige Natriumchloridlösung - also eine Kochsalzlösung). Randomisiert heißt, dass die Zuordnung zu einer der beiden Gruppen nach dem Zufallsprinzip erfolgte. Und doppelblind heißt, dass weder die Probanden noch die Wissenschaftler wissen, wer zu welcher Gruppe gehört.
Ihren ersten Zwischenbericht haben die Unternehmen veröffentlicht, nachdem sich 94 Probanden nachweislich mit dem SARS-CoV-2 Virus infiziert hatten. Die Wissenschaftler analysierten dafür, wie viele Infizierte der Impfstoffgruppe und wie viele der Placebo-Gruppe angehörten. Das vorläufige Ergebnis: Der Impfstoff soll in 90 Prozent der Fälle vor einer Infektion schützen. Zu ernsthaften Komplikationen soll es laut einer Meldung der Unternehmen nicht gekommen sein. Noch müssen die Ergebnisse eine Begutachtung durchlaufen, bei der auch die Rohdaten der Studie von unabhängigen Wissenschaftlern geprüft werden. Die Studie selbst soll noch solange weiterlaufen, bis sich mindestens 164 Teilnehmer mit dem Virus infiziert haben.
Moderna: Im Fall von Moderna sehen die Zahlen des ersten Zwischenberichtes ihrer COVE-Studie laut einer offiziellen Mitteilung des Unternehmens noch etwas besser aus. Ende Oktober hatten die letzten der 30.000 Studienteilnehmer die zweite Dosis erhalten. Die vorgelegten Ergebnisse basieren nun auf den ersten 95 Fällen einer Covid-19 Erkrankung. 90 Fälle davon traten innerhalb der Placebogruppe auf (darunter erkrankten 11 Patienten schwer), 5 in der Gruppe, die den Impfstoff erhalten hat (keiner davon mit einer schweren Erkrankung). Das Unternehmen gibt daraufhin eine Wirksamkeit von 94,5 % an. Das Placebo bestand hier ebenfalls aus einer Kochsalzlösung.
Welche Ansätze werden bei der Impfstoffsuche verfolgt?
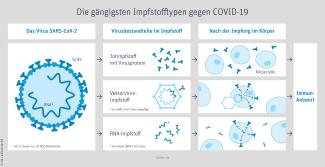
Lebend- und Totimpfstoffe
Die bis heute gängigstes Formen sind Lebend- und Totimpfstoffe. Bei ersteren werden lebende Krankheitserreger soweit abgeschwächt, dass sie zwar eine Reaktion des Immunsystems auslösen, nicht aber die Krankheit selbst. Vollständig abgetötet werden die Krankheitserreger hingegen bei Totimpfstoffen. Diese lassen sich etwas leichter gewinnen, sind aber mitunter nicht ganz so verträglich. In diesem Fall kann das Immunsystem das Virus auch noch erkennen und als gefährlich einstufen. Beispiele für Lebendimpfstoffe sind z.B: Pocken-, Mumps- oder Gelbfieberimpfungen. Beispiele für Totimpfungen sind Polio-, Tetanos- oder Tollwutimpfungen. Wobei es für verschiedene Krankheiten sowohl Tot- als auch Lebendimpfungen gibt.
Genetische Impfstoffe
Noch sehr neu sind genetische Impfstoffe. Sie verwenden die Erbsubstanz DNA des Erregers oder dessen Boten-RNA – also Moleküle, die der Übersetzung der DNA-Information in Eiweißstoffe dienen. Beide Formen – DNA- und RNA-Impfstoffe – zeigen in Tests bisher keine der bei Lebend- oder Totimpfstoffen möglichen Nebenwirkungen.
mRNA-Impfstoffe
Gegen das SARS-CoV-2 Virus nutzen einige Impfstoffprojekte die Boten-RNA oder kurz mRNA. Dieser Teil des Erbgutes ist darauf spezialisiert, ein viruseigenes Protein zu erzeugen. Das tut er auch im menschlichen Körper – und sensibilisiert damit das Immunsystem für einen möglichen Kontakt mit dem kompletten Virus. Sowohl der Impfstoff von Biontech/Pfizer als auch der von Moderna basieren auf diesem Prinzip. Wichtig zu verstehen ist, dass die virale mRNA, die mit der Impfung in den menschlichen Körper gelangt nur vorübergehend in der menschlichen Zelle bleibt und sich nicht in die menschliche DNA integriert. Unser eigenes Erbgut wird also durch diese Impfung nicht verändert.
Es wird aber nicht nur nach komplett neuen, auf das SARS-CoV-2 Virus zugeschnittenen Impfstoffen gesucht. Einige Forschungsgruppen, zum Beispiel in den Niederlanden oder in Deutschland, prüfen auch bereits vorhandene Mittel – vor allem solche gegen Tuberkulose.
Wird es genug Impfdosen geben?
Die Entwicklung eines wirksamen und sicheren Impfstoffes ist die eine Seite der Medaille. Die andere ist seine Produktion in ausreichenden Mengen und die anschließende Verteilung. Auch wenn die EU-Kommission bereits Lieferverträge mit mehreren Impfstoffherstellen abgeschlossen hat und mit weiteren verhandelt, wird gerade am Anfang nicht genug Impfstoff für alle Menschen verfügbar sein.
Um einen Vorsprung zu erhalten, hatten verschiedene Pharmaunternehmen schon vor Monaten angekündigt, mit der Ausweitung ihrer Produktionskapazitäten zu beginnen. Neben der eigentlichen Herstellung der Seren könnte die Verpackung zum Hemmnis werden.
Pfizer und Biontech schätzen, dass sie im aktuellen Jahr bis zu 50 Millionen Dosen und im kommenden Jahr bis zu 1,3 Milliarden Dosen produzieren können. Die Hälfte davon soll in den USA verbleiben. Die Europäische Union hat sich aktuell bereits 200 Millionen Dosen des Biontech/Pfizer-Impfstoffes gesichert sowie weitere 100 Millionen Dosen als Option reserviert. Sobald der Impfstoff zugelassen und verfügbar ist, soll er an die Mitgliedsstaaten in Abhängigkeit von deren Bevölkerungszahl verteilt werden. Für Luxemburg mit aktuell 626.108 Einwohnern wären das rein rechnerisch rund 420.000 Dosen. Bei zwei Impfungen pro Person, die wahrscheinlich notwendig sein werden, könnten damit etwa ein Drittel der Bevölkerung immunisiert werden.
Neben dem Biontech/Pfizer Impfstoff hat die EU noch mit weiteren Unternehmen Lieferverträge abgeschlossen. Das sind der britisch-schwedische Pharmakonzern AstraZeneca mit 300 Millionen Impfdosen, der französische Konzern Sanofi mit ebenfalls 300 Millionen sowie das amerikanische Unternehmen Johnson & Johnson mit 200 Millionen Dosen. Vereinbarungen mit CureVac (Deutschland) und Moderna (USA) wird zurzeit noch verhandelt.
Welche Personengruppen werden zuerst geimpft?
Wenn es anfangs nicht genügend Impfdosen gibt, muss überlegt werden, wer als erster eine Immunisierung erhält. Das hat die EU getan und dazu eine Impfstrategie ausgearbeitet. Diese soll den einzelnen Ländern helfen, ihre Impfkampagnen vorzubereiten. Demnach wird empfohlen, für eine frühe Impfung die folgenden Personengruppen „in Betracht zu ziehen:
- Beschäftigte im Gesundheitswesen
- Personen über 60 Jahre
- Personen, deren Gesundheitszustand sie besonders gefährdet macht
- wichtige Arbeitskräfte außerhalb des Gesundheitssektors
- Arbeitnehmer, die sich nicht sozial distanzieren können
- gefährdete sozioökonomische Gruppen und andere Gruppen mit höherem Risiko“
Eine nationale Impfstrategie für Luxemburg wird aktuell vorbereitet.
Was sind die logistischen Herausforderungen bei der Verteilung?
Als Hürde bei der Verteilung des Biontech/Pfizer Impfstoffes könnten sich die speziellen Lagerbedingungen herausstellen. Denn dieser muss bis zur Injektion auf minus 80 Grad Celsius gekühlt werden. Das Logistikunternehmen DHL glaubt, dass 25 Länder der Welt die Transportinfrastruktur dafür hätten. Vor allem in Afrika, Südamerika und Asien sieht das Unternehmen hingegen Schwierigkeiten beim Aufrechterhalten der Kühlkette.
Der Impfstoffkandidat von Moderna hat hier einen entscheidenden Vorteil. Seine Lagertemperaturen liegen „nur“ bei rund minus 20 Grad Celsius. Ein handelsüblicher Tiefkühlschrank kann hier genutzt werden. Aber auch in einem normalen Kühlschrank kann der Impfstoff wohl bis zu 30 Tage aufbewahrt werden. Und bei Raumtemperatur sei das Vakzin gar für zwölf Stunden stabil. Dies dadurch bedingt, dass die RNA des Vakzins synthetisch verstärkt wurde.
Wie wird die Verteilung weltweit aussehen?
Damit weniger entwickelte Staaten nicht ins Hintertreffen geraten, haben sich die Bill-and-Melinda-Gates-Stiftung und mehrere Pharmaunternehmen zusammengetan. Gemeinsam wollen sie sich dafür einsetzen, dass jeder auf der Welt Zugang zu möglichen Impfstoffen und Arzneimitteln erhält. Eine faire Verteilung ist auch das Ziel der COVAX-Plattform. Organisiert von der WHO, der Impfallianz GAVI und die Forschungsallianz CEPI wollen die beigetretenen Staaten zwei Milliarden Impfstoffdosen beschaffen und vor allem Entwicklungsländern so eine Versorgung zu ermöglichen. Insgesamt haben sich bereits 150 Länder der Initiative angeschlossen (Stand: 09.10.2020) Die USA verweigern aktuell ihre Teilnahme. Laut einer Erklärung aus dem Weißen Haus werden sie sich „nicht von internationalen Organisationen einschränken lassen, die von der korrupten Weltgesundheitsorganisation und China beeinflusst werden.“
Das britisch-schwedische Pharmaunternehmen AstraZeneca hat beispielsweise angekündigt, größere Mengen seines Impfstoffes nach erfolgreicher Zulassung für ärmere Regionen zu reservieren. Seit Anfang Oktober befindet sich der Vektorimpfstoff mit der Bezeichnung ChAdOx1nCoV-19 im Rolling Review Verfahren der europäischen Arzneimittelagentur EMA. Bei Erfolg will das Unternehmen 2 Milliarden Dosen produzieren. Davon sollen die Allianzen GAVI und CEPI 300 Millionen erhalten. Das indische Pharmaunternehmen Serum Institut of India hat eine Lizenz von AstraZeneca erhalten, um Impfstoffe für ärmere Länder zu produzieren.
Weshalb geht es so schnell mit der Zulassung der Impfstoffe -wenn diese Prozeduren sonst Jahre dauern?
Da die ganze Welt auf einen Impfstoff wartet und die wirtschaftlichen, gesellschaftlichen und psychologischen Folgeschäden der Coronakrise so enorm sind, ist es nachzuvollziehen, dass die Wissenschaft/Pharmaindustrie sich in einem bisher nie gekannten Ausmaß darauf fokussiert, so schnell wie möglich einen Impfstoff herzustellen. Die Tatsache dass so viele Vakzine gleichzeitig getestet werden und so viel Geld in die Entwicklung fließt, begünstigt die Wahrscheinlichkeit, dass bei einem oder mehreren Kandidaten schnell eine gute Wirksamkeit detektiert werden kann. Es geht sicherlich dabei auch um Prestige und Gewinn.
Es ist andererseits auch nachzuvollziehen, dass von Seiten der Behörden alles dafür getan wird, dass Zulassungsprozeduren, wo nur möglich verkürzt werden. Diese beiden Aspekte erklären dann auch, weshalb Prozesse, die sonst viel länger dauern, nun viel schneller vonstattengehen können.
Doch es ist sehr wichtig, dass alle Schritte und Studien zur Überprüfung der Wirksamkeit und Sicherheit eingehalten werden. Eine zu schnelle Zulassung eines Vakzins könnte viele Bemühungen zunichte machen. Denn es ist eine Sache, einen Impfstoff zu haben. Eine andere Sache ist die, ob die Menschen der Impfung vertrauen.
Fazit
Einen in Europa oder den USA zugelassenen Impfstoff gegen das SARS-CoV-2-Virus gibt es nach wie vor nicht. Die russische Zulassung zweier Präparate noch vor der entscheidenden Studie 3-Phase stieß allgemein auf große Kritik. Die größte Chance auf eine baldige Zulassung hat ein Impfstoff, den das deutsche Pharmaunternehmen Biontech gemeinsam mit dem US-Konzern Pfizer entwickelt haben. Eine Zulassung in der EU wird für das erste Quartal 2021 erwartet. Die Produktion der Impfstoffe in ausreichenden Mengen und eine faire Verteilung auf der ganzen Welt stellt aber eine große Herausforderung dar. Die Beschaffung der Impfstoffe in Europa erfolgt zentral durch die EU-Kommission. Jedes Mitgliedsland soll dabei einen Anteil entsprechend seiner Bevölkerungszahl erhalten. Die EU empfiehlt außerdem, Risikogruppen wie Ältere und Kranke aber auch medizinisches Personal zuerst zu impfen. Eine konkrete Impfstrategie für Luxemburg wird aktuell noch ausgearbeitet.
Autor: Kai Dürfeld für scienceRELATIONS – Wissenschaftskommunikation; Jean-Paul Bertemes (FNR)
Editor: Melanie Reuter (FNR)